Влияние концентрации реагентов.
Зависимость скорости реакций от концентрации реагирующих веществ описывается основным закоом химической кинетики, устанавливающий: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции, протекающей по уравнению А + В = С + Д, этот закон выразится уравнением:
V = k · CA ∙ CB , (1)
где СА и СВ – молярные концентрации вещества А и В; k – константа скорости реакции. Физический смысл константы скорости - она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1моль/л или когда их произведение равно единице.
Основной закон химической кинетики часто называют законом действующих масс.
Константа скорости реакции зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации вещества.
Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции.Для реакции, записанной в общем виде 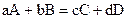 , кинетическим уравнением будет
, кинетическим уравнением будет
V = k · CmA ∙ CnB , (2)
где m и n – показатели степени, которые устанавливаются опытным путем и в большинстве случаев не равны стехиометрическим коэффициентам а и b в уравнении реакции.
Уравнение (2) является общим алгебраическим выражением закона действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам соответствующих веществ в уравнении реакции.
Сумма m + n называется порядком реакции и, как правило, имеет значение от 0 до 3 (не исключены и дробные значения и даже отрицательные).
Порядок реакции –формально-кинетическая характеристика процесса, не отражает механизма реакции, лишь характеризует зависимость скорости от концентрации.
Основной закон химической кинетики не учитывает концентрации реагирующих веществ в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь на поверхности, которая остается неизменной.
Молекулярность реакции –это молекулярно-кинетическая характеристика процесса, отражающая его механизм. Определяется числом частиц, одновременно взаимодействующих в элементарном акте.
В зависимости от количества молекул, принимающих участие в элементарном акте реакции, различают моно-, би- и тримолекулярные реакции.
Лишь для одностадийных (элементарных) реакций порядок совпадает с молекулярностью. Для простых реакций стехиометрическое уравнение отражает истинный механизм.
Дата добавления: 2015-09-18; просмотров: 852;
