Влияние температуры.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением
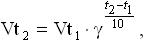
где Vt2, Vt1 - скорость реакции соответственно при начальной (t1) и конечной (t2) температурах, а γ - температурный коэффициент скорости реакции, принимающий значение от 2 до 4. Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса:
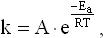
где k - константа скорости реакции, моль/л•с; А - константа, не зависящая от температуры; Т - температура, К; R - универсальная газовая постоянная, равная 8,314 Дж/моль К; Еа - энергия активизации кДж/моль.
Энергия активации –это минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все частицы вступили в химическую реакцию.
Энергия активации зависит от природы реагирующих веществ и пути протекания реакции и не зависит от температуры, если с ее изменением не произошло изменение механизма реакции.
Энергию активации определяют опытным путем и установлено, что реакции с Еа < 50 кДж/моль при 298К идут с высокой скоростью, а если Еа > 100 кДж/моль, то скорость неизмеримо мала.
Дата добавления: 2015-09-18; просмотров: 883;
