Пример 5. Рассчитайте молярную концентрацию нитрита натрия, если на титрование 20 мл его раствора, пошло 12,5 мл 0,01 М раствора дихромата калия в кислой среде.
Рассчитайте молярную концентрацию нитрита натрия, если на титрование 20 мл его раствора, пошло 12,5 мл 0,01 М раствора дихромата калия в кислой среде.
Решение: Для определения концентрации нитрита натрия воспользуемся законом эквивалентов: nэкв(ox) = nэкв(red) или СN(OX)VOX = СN(RED)VRED.
Для расчета нормальной концентрации дихромата калия запишем уравнение протекающей реакции и уравнения полуреакций:
NaN+3O2 + K2Cr+62O7 + H2SO4 ® Cr+32(SO4)3 + NaN+5O3 + H2O + K2SO4;
N+3 – 2e ® N+5
2Cr+6 + 6e ® 2Cr+3
Рассчитаем нормальную концентрацию K2Cr2O7:
СN = СМ ×z,
где z – число переносимых электронов.
СN(K2Cr2O7) = 0,01× 6 = 0,06 моль×экв/л.
Найдем концентрацию нитрата натрия по закону эквивалентов:
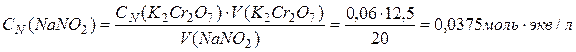 .
.
Перейдем к молярной концентрации нитрата натрия по формуле:
СМ = СN / z = 0,0375/2 = 0,01875 моль/л.
Ответ: 0,01875 моль/л.
Дата добавления: 2015-09-18; просмотров: 1453;
