СОСТАВ И СТРОЕНИЕ СТЕКОЛ
Стекла являются неорганическими аморфными термопластичными материалами (микроконгломератами), обладающими рядом специфических свойств. По своему строению и составу они представляют собой системы типа истинного затвердевшего раствора из химических соединений кислотных и основных оксидов. Имеется условное деление оксидов, входящих в стекло, на стеклообразователи и модификаторы. Оксиды SiO2, В2О3, Р2О5 относятся к стеклообразующим, поскольку каждый из них в чистом виде может самостоятельно образовать стекло; например, при 100%-ном содержании SiO2 можно получить кварцевое стекло, которое обладает наиболее высокой температурой размягчения (1250°С). Так называется температура, при которой абсолютная вязкость стекла составляет 107—108 Па∙с. Введением оксидов-модификаторов (Na2O, K2О, CaO, BaO, MgO, PbO, Al2O3, Fe2О3, Sb2O3, ZnO и др.) существенно снижают температуру размягчения стекла и придают стеклу необходимые свойства.
Если главную стеклообразующую часть стекол составляет SiO2, тогда стекла называют силикатными. В зависимости от вида и содержания добавочных оксидов стекла называют алюмосшшкатными, бороалюмосшшкатными, алюмофосфатными и т. п. В строительстве в основном применяют силикатные стекла. Подбором химического состава стекла предопределяют смесь оксидов, называемую шихтой.
Для получения силикатного стекла шихту приготовляют из различных сырьевых материалов, содержащих необходимые оксиды: кварцевый песок, сода или сульфат натрия, поташ, известняк и мел, доломит, пегматит, каолин, полевой шпат и др. В малых количествах в составы вводят стеклянный бой, красители (оксиды меди, хрома, кобальта, марганца и др.), осветлители (триоксид мышьяка, селитру и др.), глушители и др. В последнее время используют отходы: доменные шлаки, кварцсодержащие материалы, тетраборат кальция и другие. Перемешивание измельченных компонентов в строго отдозированных количествах (согласно расчетам) производят в смесителях барабанного или тарельчатого типа. Готовую шихту загружают в ванную печь—бассейн, сложенный из огнеупорных брусьев, или в горшковую печь. Бассейны больших ванных печей вмещают до 2500 т стекломассы — пластичного расплава шихты, образующегося при температуре свыше 1000°С.
При нагревании шихты до температуры 1100—1150°С происходят химические процессы силикатообразования, а при дальнейшем повышении температуры — стеклообразования. Шихта превращается в однородную (гомогенную) стекломассу, но со значительным содержанием в ней газовых включений (H2O, СО2 и др.). Осветление и дальнейшая гомогенизация стекломассы осуществляются при температуре 1500—1600°С, вязкость ее при этом уменьшается (до 10 Па∙с), что облегчает удаление газовой фазы. Последний этап варки стекла — охлаждение (студка) стекломассы. Чем медленнее происходит охлаждение стекломассы, тем больше вероятность перехода ее в кристаллическое состояние; чем выше скорость охлаждения, тем более высокой температуре соответствует «замороженное» состояние структуры.
Практически формовка стекла, отобранного из печи, может производиться при вязкости его не менее 100 и не более 105 Па∙с. К концу формовки вязкость может быть до 108 Па∙с. У различных стекол зависимость вязкости г| от температуры различна (рис. 18.1). Очевидно, что стекло легче обрабатывать, если стекломасса длинная, когда высокая вязкость обеспечивается при сравнительно медленном охлаждении. Например, стекла щелочные не только легкоплавкие, но и длинные. Введение CaO, MgO, Al2O3 переводит щелочные стекла в более короткие. Готовые стеклянные изделия часто подвергают отжигу, т. е. нагреву до достаточно высокой температуры (температуры отжига) с последующим медленным охлаждением. Отжигом снимают внутренние температурные напряжения в отформованных изделиях, что предотвращает их трещинообразование. При необходимости стекло можно снова нагреть и расплавить, при этом оно приобретает первоначальные свойства стекломассы, и переформовать в новые изделия.
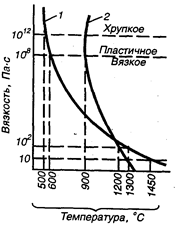
Рис. 18.1. Характер зависимости вязкости стекломассы от температуры:
1 — стекломасса длинная; 2 — стекломасса короткая
В процессе производства стекла и особенно на стадии его охлаждения возникает структура, которая может
быть охарактеризована как промежуточная между полной беспорядочностью частиц жидкого расплава и полной упорядоченностью частиц вещества в кристаллическом состоянии. Неорганические стекла — это по существу субмикрогетерогенные системы, что позволяет по одной из гипотез рассматривать их структуру как скопление микрокристаллических, а точнее — кристаллитных образований размером от 10 до 300  .
.
Согласно другой гипотезе в структуре стекла имеется непрерывная беспорядочная пространственная сетка (трехмерная). В ее узлах расположены ионы, атомы или группировки атомов. Например, в кварцевом стекле ионы Si расположены в центре тетраэдров, в углах которых размещены ионы О. При соединении тетраэдров SiO4 между собой (через один ион кислорода) вершинами образуется непрерывная пространственная сетка, или каркас стекла (рис. 18.2). В промежутках между тетраэдрами могут располагаться ионы металлов (флюсов), например в силикатных стеклах. Тогда возникают не только ковалентные, как в кварцевых стеклах, но и ионные связи, которые частично разобщают тетраэдры, уменьшают количество и силу поперечных связей (рис. 18.3), за счет чего уменьшается стабильность, характерная для структуры стеклообразных чистых оксидов, легче предотвращается кристаллизация, понижается температура плавления. Всякое силикатное стекло можно рассматривать как совокупность различных по составу и строению кремнекислородных комплексов. Кристаллитная гипотеза Лебедева и гипотеза неупорядоченной сетки Захариасена рассматривают стекло как полимерное образование в виде непрерывной пространственной сетки с различной степенью упорядоченности в расположении атомов. Максимально упорядоченные области — кристаллиты, т. е. предельно маленькие кристаллы, состоящие из очень небольшого числа элементарных ячеек.
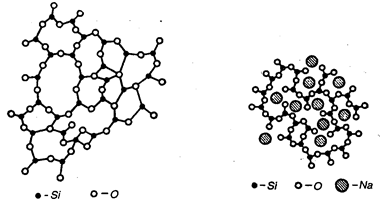
Рис. 18.2. Ионные связи в молекуле кварцевого стекла
Рис. 18.3. Ионные связи в присутствии флюса (Na)
В настоящее время большинство ученых придерживается полимерного полиморфно-кристаллоидного строения стекла. Кристаллоид — частицы вещества, находящиеся в молекулярном раздроблении и способные к кристаллизации. Носители дальнего порядка (ДП) — кристаллиты — модифицируются в кристаллоиды, не имеющие дальнего порядка, а понятие полимеризации расширяется в понятие полиморфной полимеризации, в. которой участвуют кристаллоиды. Природа стекла и его свойства определяются концентрационным соотношением кристаллоидов различных полиморфных модификаций (ПМ) и его изменением в зависимости от внешних воздействий (температура, давление и др.). При охлаждении стекломассы происходит: а) перемещение и объединение звеньев цепей, фрагментов двух- и трехмерных сеток, т. е. полимеризация и б) превращение кристаллоидов одних ПМ в кристаллоиды других ПМ, причем второе при стеклообразовании является определяющим. Таким образом, полимерно-кристаллитная концепция трансформируется в полимерно-кристаллоидную концепцию, а учитывая, что при стеклообразовании сополимеризуются кристаллоиды различных ПМ, — в концепцию полимерного полиморфно-кристаллоидного строения стекла, в котором порядок и некоторый беспорядок сосуществуют.
Дата добавления: 2015-09-18; просмотров: 1544;
