СТРУКТУРА И ПРИРОДА СВОЙСТВ КЕРАМИЧЕСКИХ МАТЕРИАЛОВ
При нагревании глинистой массы (или сырца), подготовленной определенным образом к термической обработке, до температур 110—250°С происходит испарение из различных глинообразующих минералов и пор изделия свободной и адсорбированной воды. В интервале температур 250—900°С происходит дегидратация, например каолинита в интервале температур 520—590°С, монтмориллонита и гидрослюд — при температурах 800—850°С. Этот процесс является эндотермическим и сопровождается небольшой усадкой обжигаемого сырья. Вместо кристаллического каолинита в сырце-изделии образуется аморфный метакаолинит Al2O3∙2SiO2. Примерно в этом же температурном интервале происходит диссоциация карбонатов с выделением СО2, сгорание органических примесей.
При дальнейшем нагревании дегидратированные соединения распадаются на первичные оксиды (глинозем, кремнезем и др.), в интервале температур 900—1250°С возникают в состоянии твердых фаз новые алюмосиликаты — неустойчивый силлиманит Al2O3∙SiO2, кристаллический муллит (типа природного) 3Al2O3∙2SiO2. Содержание последнего возрастает с повышением температуры, а процесс муллитизации (рост количества муллита) сопровождается экзотермическим эффектом и усадкой с уплотнением расплава. Наиболее интенсивное образование муллита происходит в интервале температур 1000—1200°С. Процесс перекристаллизации силлиманита в муллит следует по реакции 3(Al2O3∙SiO2) = 3 Al2O3∙2SiO2 + SiO2. Чем больше образуется новых соединений природного муллита, тем выше стойкость изделия к высоким температурам.
В результате последующего нагревания оставшийся свободный кремнезем из аморфного состояния переходит в кристаллическое с образованием кристобалита, возникает шпинель, например MgAl2O4 что сопровождается усадочными явлениями, а при температуре 1300°С и выше растворяется в стекле. При достижении критической температуры для данной системы сырьевая масса постепенно переходит в жидкое состояние, которое является расплавом и, кооме того содержит не полностью растворившиеся тугоплавкие минералы. В системе Al2O3 — SiO2 наиболее низкоплавкой точкой (1595°С) служит эвтектика между кристобалитом и муллитом при содержании 94% SiO2 (по массе). При других соотношениях этих оксидов в соединениях температура плавления от эвтектической быстро повышается, а у муллитй (28% SiO2 по массе) составляет уже 1850°С. Между температурами 1595—1850°С твердый муллит находится в жидком расплаве. Присутствие плавней существенно уменьшает число сильных ионных связей кислорода с атомами металла и способствует образованию слабых — с атомами флюса и с понижением точки плавления.
Таким образом, химическое взаимодействие компонентов глинистой массы начинается еще на стадии твердых фаз, а с ростом температуры нагревания масса постепенно переходит в жидкое состояние. Керамический расплав состоит из большого количества простых и сложных соединений.
При охлаждении керамического расплава наиболее характерным процессом является кристаллизация, которая проявляется в выпадении первых сравнительно чистых от примесей кристаллов и их последующем росте. Чистые компоненты, обладающие наименьшей плавкостью (растворимостью), к которым относятся в глинистых веществах в первую очередь Al2O3 и SiO2, способны выделяться в виде кристаллов корунда и а-кристобалита при температурах соответственно 2050 и 1723°С. Ввиду наличия минеральных примесей
происходит быстрый процесс муллитизации, причем при температуре 1595°С образуется твердая эвтектика между кристобалитом и муллитом (рис. 17.4). Кристаллизация в полной мере пройти не успевает, так как при принятой скорости охлаждения большая или меньшая часть расплава с выпавшими в нем кристаллами становится переохлажденной жидкостью, т. е. стеклом.

Рис. 17.4. Диаграмма состояния расплавов
Дальнейшее охлаждение сопровождается переходом α-кристобалита в β-кристобалит, а затем в β-кварц и α-кварц. Присутствие плавней и других примесей может весьма значительно смещать в сторону меньших температур границы этих аллотропических видоизменений кремнезема.
В результате отвердевания расплава образуется микроконгломерат, в котором кристаллические зерна муллита, кремнезема разных модификаций, других видов веществ, кристаллизующихся при остывании (в основном алюмосиликатов), сцементированы аморфной массой отвердевшего расплава. Поскольку на более ранней технологической стадии расплав был или мог быть объединен с огнеупорным заполнителем, образовавшийся микроконгломерат — вяжущее вещество — окаймляет отдельные зерна заполнителя и размещается в межзерновых пустотах. После охлаждения образуется обжиговый ИСК, в котором, кроме того, имеются контактные слои вяжущей части с поверхностью заполнителя. Нередко при обжиге используются вспучивающиеся глины. Тогда структура керамики становится в той или иной мере пористой. Чем большей вспучиваемостью обладает сырье, тем больший объем пор и меньшая средняя плотность у соответствующего ИСК.
Типичная технология производства строительной керамики предусматривает обжиг изделий в печах до температуры спекания, при которой расплав частично или полностью заполняет поры и капилляры сырца, смачивая поверхность заполняющих или образующихся (например, кристаллический кремнезем) твердых частиц керамической смеси. При охлаждении расплава происходит процесс кристаллизации и остекловывания, который в получаемом обжиговом (до спекания) конгломерате выполняет функцию вяжущего вещества — высокотемпературного цемента (по выражению А.А. Байкова). Огневая усадка глин составляет 2—8%.
В последнее время исследования (П.И. Боженов, Б.А. Григорьев и др.) показали, что при обжиге в условиях вакуума продолжительность обжига сокращается в несколько раз и при более низких температурах — на 100—150°С по сравнению с обжигом на воздухе. Обожженные в вакууме строительные конгломераты (кирпич, фаянсовые плиты и др.) имели повышенные показатели прочности, морозостойкости. Муллит образовывался при меньшей продолжительности изотермической выдержки, что благоприятствовало снижению энергозатрат (до 5%).
Сформировавшиеся микроструктуры керамического вяжущего вещества, подобно вяжущему безобжиговых конгломератов, представлены стекломассой, и кристаллическими фазами, которые цементируют остальную массу частиц изделия. При обжиге под вакуумом электротехнического фарфора была установлена изотропная кайма толщиной 0,5—1 мкм, окружавшая все зерна кварца. Кристаллическая фаза представлена муллитом Al6Si2O13 и другими новообразованиями, а также свободными кремнеземом в различных его аллотропических видоизменениях, некоторыми оксидами в кристаллическом состоянии, не вступившими в химическое взаимодействие во время термической обработки сырья. Стекловатая, аморфная фаза (переохлажденная жидкость) вяжущей части представлена в микроструктуре легкоплавкими компонентами, которые не успели выкристаллизоваться при заданной скорости остывания расплава.
Рис. 17.5. Керамика как комбинация атомов металла и неметалла (обычно кислорода); пример оксида магния: белые шарики на рисунке — атомы кислорода (шесть), черные — атомы металла (магния), связи — ионные: атом металла отдает два электрона атому кислорода
Вяжущая часть в процессе обжига может быть подвергнута вспучиванию за счет введения соответствующих добавок с эффектом поризации микроструктуры.
Если микроструктуру керамики рассматривать на атомно-молекулярном уровне, то ее можно охарактеризовать как комбинацию атомов металла с атомами неметалла, чаще всего с кислородом. Как отмечает Д. Гальман, относительно большие атомы кислорода образуют матрицу, в которой маленькие атомы металлов (Al, Mg, Si и др.) помещаются в промежутках между ними (рис. 17.5), причем в кристаллах керамики превалируют ионные и в несколько меньшей мере — ковалентные связи. Эти прочные связи предопределяют прочность и стабильность, химическую стойкость и долговечность керамических материалов, что обусловлено, в частности, их высокоокисленным составом, т. е. большим содержанием кислорода.
Микроструктура керамики далека от совершенства, так как в кристаллических решетках имеются дефекты в виде вакансий или пор атомного размера, дефекты по границам контакта между кристаллами, деформации и поры, поэтому прочность керамики значительно уступает прочности идеальных кристаллов. Однако в целом керамика обладает комплексом высоких качественных показателей, который согласуется с определенным фазовым соотношением стекла и кристаллов, особенно при оптимальной структуре. Так, например, на рис. 17.6 приведены кривые изменения фазового состава и свойств керамических плиток, обожженных по скоростному режиму (по экспериментальным данным В.Ф. Павлова). Видно проявление закона створа применительно к этой разновидности керамических материалов.
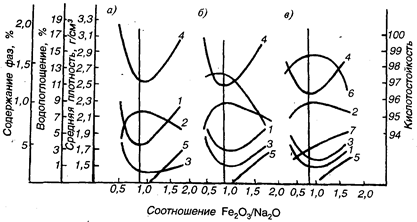
Рис. 17.6. Закон створа в отношении керамического сплава Fe2O3 и Na2O в плиточных массах с добавкой стекол:
а — 1000°С; б — 1050°С; в — 1 100°С; 1 — водопоглощаемость; 2 — кажущаяся плотность; 3 — содержание кристобалита; 4 — содержание кварца; 5 — содержание гематита; 6 — кислотостойкость; 7 — содержанке муллита
Средняя плотность керамических материалов равна от 200 до 2300 кг/м3, предел прочности при сжатии Rсж = 0,05 — 1000 МПа, водопоглощение 0 — 70%, марки по морозостойкости: 15, 25, 35, 50, 75, 100, теплопроводность 0,07 — 1,16 Вт/(м∙К).
Дата добавления: 2015-09-18; просмотров: 1175;
