Електронна хмара
Одноатомні спирти можна розглядати як похідні насичених вуглеводнів, в молекулах яких один атом Гідрогену заміщений на гідроксильну групу. У цих молекулах атоми сполучені між собою ковалентними 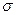 - зв’язками. (мал. 21)
- зв’язками. (мал. 21)
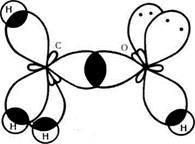
Мал. 21 Схема утворення 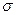 -зв'язків у молекулі метанолу.
-зв'язків у молекулі метанолу.
Особливості електронної будови альдегідів і кетонів зумовлені наявністю в їх молекулах карбонільної групи. В карбонільні групі атом Карбону перебуває в стані sp2 –гібридизації. В формальдегіді три орбіталі атома Карбону витрачаються на утворення 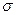 - зв’язків з двома атомами гідрогену і атомом Оксигену (мал. 22) . Ці зв’язки, як і в молекулі етилену, розташовані в одній площині під кутом 120 о. Орбіталь негібридизованого р – електрона атома Карбону розташована перпендикулярно до площини
- зв’язків з двома атомами гідрогену і атомом Оксигену (мал. 22) . Ці зв’язки, як і в молекулі етилену, розташовані в одній площині під кутом 120 о. Орбіталь негібридизованого р – електрона атома Карбону розташована перпендикулярно до площини 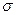 - зв’язку. Атом Оксигену однією р – орбіталлю сполучений з атомом Карбону (зв’язок С – О), другою р – орбіталлю, розташованою перпендикулярно до першої, утворює з не гібридизованою р – орбіталлю Карбону
- зв’язку. Атом Оксигену однією р – орбіталлю сполучений з атомом Карбону (зв’язок С – О), другою р – орбіталлю, розташованою перпендикулярно до першої, утворює з не гібридизованою р – орбіталлю Карбону  - зв’язок. Не дивлячись на певну подібність в електронній будові карбонільної групи і подвійного зв’язку молекули етилену, між ними існує велика різниця: електронна густина в молекулі етилену рівномірно і симетрично розподілена між атомами Карбону; в карбонільній групі електронна густина зміщена від Карбону до Оксигену як до більш електронегативного атома, тобто зв’язок С = О сильно полярний: на атомі Карбону виникає частковий позитивний заряд, на атомі Оксигену – частковий негативний:
- зв’язок. Не дивлячись на певну подібність в електронній будові карбонільної групи і подвійного зв’язку молекули етилену, між ними існує велика різниця: електронна густина в молекулі етилену рівномірно і симетрично розподілена між атомами Карбону; в карбонільній групі електронна густина зміщена від Карбону до Оксигену як до більш електронегативного атома, тобто зв’язок С = О сильно полярний: на атомі Карбону виникає частковий позитивний заряд, на атомі Оксигену – частковий негативний:
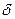 +
+ 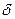 -
- 
R 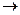 C = O
C = O
I
H
Дата добавления: 2015-09-18; просмотров: 1290;
