Определение и классификация оксидов
О к с и д ы
Определение и классификация оксидов
Оксиды – сложные вещества, состоящие из атомов двух элементов, один из которых – кислород в степени окисления –2, например:
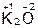 ,
, 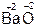 ,
, 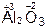 ,
, 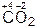 ,
, 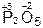 ,
, 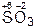 ,
, 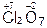 ,
, 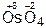 .
.
В зависимости от кислотно-основных свойств, все оксиды подразделяются на три большие группы – оснóвные, кислотные и амфотерные оксиды.
Оснóвными называются оксиды, которым соответствуют основные гидроксиды – основания.
К основным относятся оксиды металлов в степенях окисления +1, +2 (кроме Zn, Be, Sn, Pb), +3 (кроме Al, Cr, Fe), например:
| Формула основного оксида | Формула соответствующего основания |
| Li2O | LiOH |
| Na2O | NaOH |
| K2O | KOH |
| MgO | Mg(OH)2 |
| CaO | Ca(OH)2 |
| BaO | Ba(OH)2 |
| FeO | Fe(OH)2 |
| MnO | Mn(OH)2 |
| La2O3 | La(OH)3 |
Кислотными являются оксиды, которым соответствуют кислотные гидроксиды – кислородсодержащие кислоты.
К кислотным относятся оксиды неметаллов (кроме СО, NO и N2O), а также оксиды металлов – d-элементов, атомы которых находятся в высоких степенях окисления +5, +6 и +7, например:
| Формула кислотного оксида | Формула соответствующей кислоты |
| Cl2O | HClO |
| N2O3 | HNO2 |
| N2O5 | HNO3 |
| SO2 | H2SO3 |
| SO3 | H2SO4 |
| P2O5 | H3PO4 |
| Cl2O7 | HClO4 |
| CrO3 | H2CrO4 |
| Mn2O7 | HMnO4 |
Амфотерными называются оксиды, которым соответствуют амфотерные гидроксиды. К таким оксидам относятся оксиды ряда металлов, например:
| Формула амфотерного оксида | Формула амфотерного гидроксида |
| ZnO | Zn(OH)2 |
| BeO | Be(OH)2 |
| SnO | Sn(OH)2 |
| PbO | Pb(OH)2 |
| Al2O3 | Al(OH)3 |
| Cr2O3 | Cr(OH)3 |
Оснóвные, кислотные и амфотерные оксиды вступают в различные реакции солеобразования, поэтому их называют солеобразующими. Почти все известные оксиды – солеобразующие. Исключением являются оксиды CO, SiO, NO, N2O, у которых нет соответствующих гидроксидов. Эти оксиды не вступают в реакции солеобразования и поэтому называются несолеобразующими.
Дата добавления: 2015-09-18; просмотров: 863;
