Получение оксидов
Для получения оксидов используют различные способы:
1. Взаимодействие простых веществ с кислородом:
С + O2 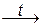 СO2; S + O2
СO2; S + O2 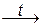 SO2; 4Al + 3O2
SO2; 4Al + 3O2 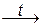 2Al2O3.
2Al2O3.
2. Взаимодействие сложных веществ с кислородом:
2H2S + 3O2 = 2SO2 + 2H2O; СН4 + 2О2 = СО2 + 2Н2О.
3. Термическое разложение малорастворимых оснований. При этом образуется основный или амфотерный оксид и вода:
Mg(OH)2 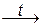 MgO + H2O; 2Al(OH)3
MgO + H2O; 2Al(OH)3 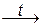 Al2O3 + 3H2O.
Al2O3 + 3H2O.
4. Термическое разложение некоторых кислот. При этом образуются кислотный оксид и вода:
H2CO3 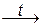 CO2 + H2O; H2SiO3
CO2 + H2O; H2SiO3 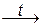 SiO2 + H2O; H2SO3
SiO2 + H2O; H2SO3 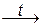 SO2 + H2O.
SO2 + H2O.
5. Термическое разложение некоторых солей, например, карбонатов или сульфитов двухвалентных металлов. При этом образуются по два оксида – основный или амфотерный и кислотный:
CaCO3 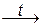 CaO + CO2; ZnCO3
CaO + CO2; ZnCO3 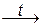 ZnO + CO2.
ZnO + CO2.
6. Действие водоотнимающих веществ (фосфорный ангидрид, концентрированная серная кислота) на некоторые кислородсодержащие кислоты:
2HNO3 + P2O5 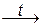 N2O5 + 2HPO3; H2SO4 + P2O5
N2O5 + 2HPO3; H2SO4 + P2O5 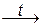 SO3 + 2HPO3.
SO3 + 2HPO3.
Некоторые оксиды являются природными соединениями (минералами): H2O – вода, SiO2 – кварц, Al2O3 – корунд, Fe2O3 – гематит, MnO2 – пиролюзит, TiO2 – рутил, SnO2 – касситерит и др.
Дата добавления: 2015-09-18; просмотров: 817;
