ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. 1. Методом кислотно-основного титрования определить карбонатную жёсткость водопроводной воды.
Содержание работы:
1. Методом кислотно-основного титрования определить карбонатную жёсткость водопроводной воды.
2. Методом комплексонометрического титрования определить общую жёсткость водопроводной воды.
3. По экспериментальным данным сделать вывод об уровне жёсткости исследованной воды и рассчитать величину постоянной жёсткости.
Опыт 1. Определение карбонатной жёсткости
В две конические колбы налить по 100 мл исследуемой (водопроводной) воды (отмерив ее мерным цилиндром), добавить
5-6 капель раствора индикатора метилового оранжевого. Одна из колб является контрольной, т.е. используется, чтобы заметить изменение окраски раствора в другой колбе при титровании. Записать начальный уровень титранта в бюретке.
Перед титрованием убеждаются, что в бюретке достаточно раствора, а стеклянный носик полностью заполнен жидкостью. Пузырьки воздуха из носика выдавливают потоком жидкости, повернув трубку носика вверх под углом около 45°. Выпускное устройство бюретки представляет резиновую трубку со стеклянным шариком внутри. Для вытекания жидкости слегка оттягивают большим и указательным пальцем стенку трубки от шарика, чтобы между ними образовался просвет. Наполняют бюретку через воронку, после чего воронку вынимают из верхнего отверстия; если этого не сделать, во время титрования с воронки может стечь оставшийся в ней раствор, и измерение объема окажется неточным.
При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Во вторую колбу из бюретки прибавлять 0,1 н. раствор соляной кислоты до перехода окраски индикатора из желтой в оранжевую (получаемый цвет, скорее, можно назвать персиковым).
Поверхность жидкости в бюретке представляется широкой вогнутой полосой (мени́ск). Отсчет значений по шкале производят по нижнему краю мениска, глаз наблюдателя должен находиться на уровне мениска. Титрант из бюретки сначала приливают достаточно быстро, непрерывно перемешивая содержимое колбы вращательными движениями. На шарик надавливают левой рукой, а колбу держат и перемешивают правой рукой. Титрование проводят стоя! За окраской раствора наблюдают, подложив под колбу лист белой бумаги для лучших условий наблюдения. По мере приближения к концу титрования, о чем можно судить по появлению в центре колбы «облачка» розовой окраски, тут же исчезающего при дальнейшем перемешивании, титрант приливают уже по каплям. Раствор должен изменить цвет от прибавления одной определенной капли; в этот момент розовое «облачко» не исчезнет, а распространится по всему раствору.
Чтобы убедиться в отсутствии значительных случайных ошибок при выполнении титрования и при отмеривании объема титруемого раствора, титрование повторяют два-три раза и рассчитывают среднюю величину Vстанд, которую в дальнейшем используют для расчетов.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить (можно использовать «контрольную колбу»). Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить карбонатную жёсткость Жкарб исследуемой воды (в ммоль экв/л) по формуле:
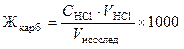 ,
,
где СHCl — молярная концентрация эквивалента (нормальность) раствора соляной кислоты; VHCl — объем соляной кислоты, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
Опыт 2. Определение общей жёсткости
Титрование проводят в присутствии индикатора «хром темно-синий». В коническую колбу налить 25 мл исследуемой воды и добавить дистиллированной воды до общего объема 100 мл (отмерять цилиндром). Добавить 5 мл аммиачного буферного раствора и
5-7 капель раствора индикатора хрома темно-синего; при этом раствор приобретает винно-красную окраску.
Записать начальный уровень титранта в бюретке. При необходимости долить раствор титранта в бюретку, доведя уровень до нулевого деления. Из бюретки по каплям прибавлять 0,1 н. раствор трилона Б до изменения окраски раствора от винно-красной до синевато-сиреневой.
В отличие от титрования в первом опыте, где реакция протекает практически мгновенно, взаимодействие трилона Б с кальцием и магнием требует некоторого заметного промежутка времени. Чтобы не пропустить момент достижения точки эквивалентности, титрант с самого начала титрования добавляют отдельными каплями с интервалом в две-три секунды, внимательно наблюдая, не меняется ли окраска титруемого раствора. Если приливать титрант быстрее, то некоторое количество его попадет в уже оттитрованный раствор, который еще не успел поменять окраску; в результате раствор будет перетитрован, а объем пошедший на титрование — завышен.
Записать уровень раствора в бюретке и вычислить объем титранта, пошедший на титрование, как разность конечного и начального отсчетов. Титрование повторить. Рассчитать объем стандартного раствора как среднее по результатам двух титрований. Вычислить общую жёсткость Жобщ исследуемой воды (в ммоль экв/л) по формуле:
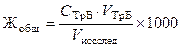 ,
,
где СТрБ — молярная концентрация эквивалента (нормальность) раствора трилона Б; VТрБ — объем трилона Б, пошедший на титрование; Vисслед — объем исследуемой воды; 1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
По полученным данным сделать вывод об уровне жёсткости исследованной воды.
Пренебрегая вкладом карбонатов в величину постоянной жёсткости и считая, что в данном случае временная жёсткость воды совпадает с карбонатной жёсткостью, т.е. Жкарб = Жвр, рассчитать постоянную жёсткость воды по разности между общей и временной жёсткостью.
Жпост = Жобщ – Жвр.
* расчет массы одного моля эквивалента вещества или отдельного иона (иногда говорят просто «химического эквивалента» и используют обозначение Э) см. далее в материале к лабораторной работе «Жёсткость воды» (с. 90—91)
*барботирование (барботаж) — пропускание через слой жидкости газа (или пара), подаваемого обычно через распределительное устройство с большим количеством мелких отверстий (барботёр) в нижней части аппарата
*Казимир Фаянс (1887—1975) — американский физикохимик; Н. П. Песков (1880—1940) советский физикохимик, автор монографии «Физико-химические основы коллоидной науки» (1934 г.)
*Ганс Шульце (1853—1892) — немецкий химик, Уильям Гарди (1864—1934) — английский биолог; изучали устойчивость коллоидных растворов
* чтобы упростить изложение, здесь и далее не рассматривается, что MgCO3 реагирует с горячей водой с образованием гидроксида магния и при кипячении воды разложение гидрокарбоната магния происходит по реакции:
Mg(HCO3)2 = Mg(OH)2↓ + 2CO2↑
* по ранее принятой терминологии мг-экв/л
* см. примечание на с. 80
* лигнин — полимерное соединение, составляющее 20-30 % от массы древесины; в промышленности получают как отход при производстве целлюлозы
*используют также термин титрованные растворы, так как для всех растворов, используемых в титриметрии, значение концентрации всегда можно установить путем титрования другим подходящим стандартным раствором
Дата добавления: 2015-09-14; просмотров: 1218;
