ТЕОРЕТИЧЕСКАЯ ЧАСТЬ. 1.1.1. Компоненты и виды жёсткости
1.1. Жёсткость воды
1.1.1. Компоненты и виды жёсткости
Природная пресная вода, которая широко используется в технологических процессах, в качестве питьевой воды и для хозяйственно-бытовых нужд, находится в непрерывном взаимодействии с окружающей средой. Она реагирует с компонентами атмосферы, почвы, растений, с минералами и различными породами, растворяя различные органические и неорганические соединения. Состав природных вод является результатом этих взаимодействий.
В наибольшем количестве в природной воде содержатся:
— катионы: ионы металлов натрия Na+, калия K+, кальция Ca2+ и магния Mg2+;
— анионы: карбонат-ионы CO32–, гидрокарбонат-ионы HCO3–, сульфат-ионы SO42–, хлорид-ионы Cl–;
— растворенные газы атмосферного воздуха — углекислый газ CO2 и кислород O2.
Практически все соли натрия и калия хорошо растворимы в воде, в т.ч. и те, которые натрий и калий образуют в сочетании с вышеперечисленными анионами. Изменение температуры воды, её солевого состава, величины pH, концентрации CO2 в атмосфере не приводят к каким-либо химическим процессам, связанным с присутствием ионов натрия и калия.
Напротив, многие соли кальция и магния ограниченно растворимы, и в результате изменения температуры, pH, давления CO2, внесения реагентов растворенные до того ионы кальция и магния могут образовывать осадок. Поэтому наличие ионов Ca2+ и Mg2+ является одной из важнейших характеристик природной воды. Присутствие указанных ионов в воде принято обозначать термином жёсткость воды. Соответственно, вода, которая не содержит соли кальция и магния или содержит в очень незначительных количествах, характеризуется как мягкая вода.
Ионы Ca2+ и Mg2+ появляются в природных водах в результате взаимодействия их с известняками (CaCO3), доломитами (CaCO3∙MgCO3), гипсом CaSO4. В отличие от случая взаимодействия воды с гипсом, переход кальция и магния в раствор из карбонатных пород (известняков и доломитов) является результатом не простого растворения солей, а химического процесса при участии углекислого газа, которым насыщена вода водоемов (CO2 из атмосферы) и почва (CO2 появляется в ходе разложения органических компонентов). При этом малорастворимые карбонаты переходят в растворимые гидрокарбонаты по реакциям:
CaCO3 + CO2 + H2O = Ca(HCO3)2 ;
MgCO3 + CO2 + H2O = Mg(HCO3)2 .
Суммарное содержание ионов кальция и магния определяет общую жёсткость воды. Поскольку каждый из этих ионов входит в состав разных солей, то в суммарной величине общей жёсткости различают различные виды жёсткости. Деление можно провести по трем критериям:
1. По катиону
— кальциевая жёсткость, связанная с присутствием солей Ca;
— магниевая жёсткость, связанная с присутствием солей Mg.
2. По анионам, образующим соли, придающие воде жёсткость:
— карбонатная жёсткость; обусловлена содержанием в воде карбонатов и гидрокарбонатов кальция и магния CaCO3, MgCO3, Ca(HCO3)2, Mg(HCO3)2;
— некарбонатная жёсткость; обусловлена содержанием в воде сульфатов и хлоридов кальция и магния CaSO4, MgSO4, CaCl, MgCl, т.е. растворимых солей сильных кислот.
3. По способу устранения жёсткости
— временная жёсткость — часть общей жёсткости, удаляемая кипячением воды при атмосферном давлении в течение 1 часа. Эта жёсткость может быть названа также гидрокарбонатной, поскольку обусловлена присутствием гидрокарбонатов кальция
и магния, которые при кипячении переходят в малорастворимые
карбонаты кальция и магния согласно уравнениям реакций:
Ca(HCO3)2 = CaCO3↓ + CO2↑ + H2O ;
Mg(HCO3)2 = MgCO3↓ + CO2↑ + H2O*.
При этом бо́льшая часть кальция и магния, содержавшаяся в гидрокарбонатах, уходит из раствора в виде осадков, но небольшая часть кальция и магния остается в растворе, так как осажденные карбонаты обладают некоторой растворимостью в воде (CaCO3 — 13 мг/л; MgCO3 — 110 мг/л), хотя и намного меньшей, чем гидрокарбонаты, из которых они образовались. Та часть карбонатной жёсткости, которая остается после кипячения воды и удаления тем самым гидрокарбонатной жёсткости, называется остаточной карбонатной жёсткостью.
— постоянная жёсткость — часть общей жёсткости, остающаяся после кипячения воды; эта жёсткость обусловлена присутствием карбонатов, сульфатов и хлоридов кальция и магния. Таким образом, постоянная жёсткость равна разности между общей и временной. С другой стороны, постоянная жёсткость равна сумме некарбонатной жёсткости и остаточной карбонатной.
1.1.2. Действие жёсткости
Соли, обусловливающие жёсткость воды, не являются вредными для здоровья. Жёсткость не ухудшает вкус питьевой воды, жесткая вода вкуснее мягкой. Однако жёсткость воды — нежелательное явление в ряде случаев:
1) При использовании жёсткой воды в отопительных системах, других системах приготовления и подачи горячей воды вследствие разложения гидрокарбонатов образуется накипь на внутренней поверхности кипятильного сосуда — от парового котла до чайника. Слой плотного осадка ухудшает условия передачи тепла через стенку котла, поскольку теплопроводность накипи в десятки раз меньше теплопроводности стали. Это приводит к перерасходу топлива. Кроме того, металл под накипью перегревается и размягчается, образуются вздутия и трещины, что может привести к разрыву котлов. Также внутреннее пространство труб, по которым подается горячая вода, постепенно забивается выпадающими в осадок солями.
2) Присутствие в воде солей MgSO4 и MgCl2 приводит к коррозии, поскольку гидроксид магния — весьма слабое основание и гидролиз солей сильных кислот магния приводит к образованию кислой среды.
Например, в ходе гидролиза образуются слабое основание и сильная кислота:
MgCl2+ H2O = Mg(OH)2 + 2HCl.
Затем ионы водорода взаимодействуют с железом:
Fe + 2HCl = FeCl2 + H2↑,
а в присутствии кислорода процесс окисления железа идет далее до образования трехвалентных ионов:
4FeCl2 + 4HCl + O2 = 4FeCl3 + 2H2O.
Последующая обменная реакция с накопившимся гидроксидом магния приводит к образованию ржавчины:
2FeCl3 + 3Mg(OH)2 = 2Fe(OH)3 + 3MgCl2.
3) При использовании в качестве моющего средства обычного мыла, которое представляет собой натриевые соли органических карбоновых кислот (так называемых жирных кислот — пальмитиновой СН3(СН2)14СООН и стеариновой СН3(СН2)16СООН) в жёсткой воде происходит выпадение осадка нерастворимых кальциевых солей этих кислот:
2СН3(СН2)14СООNa + Ca2+ = (СН3(СН2)14СОО)2Ca↓ + 2Na+.
Это приводит, во-первых, к непроизводительному расходу мыла, поскольку сначала оно частично расходуется на связывание солей жёсткости, а только затем может проявить свои моющие свойства (в мягкой воде, наоборот, возникает ощущение, что мыло с трудом смывается с рук). Во-вторых, если использовать мыло в жёсткой воде для стирки, волокна тканей адсорбируют кальциевые и магниевые мыла, что делает ткани хрупкими и ломкими, ведет к потере прочности и преждевременному износу.
4) В жёсткой воде овощи и мясо плохо развариваются, так
как соли кальция с белками пищевых продуктов образуют нерастворимые соединения, которые делают мякоть и кожицу плодов твердыми.
5) Чай в жёсткой воде плохо заваривается, поскольку наличие солей ухудшает условия экстракции (так называется переход веществ в воду из контактирующего с ней твердого вещества или несмешивающейся жидкости).
1.1.3. Единицы измерения жёсткости
Единой международной единицы измерения жёсткости не существует. В отечественной нормативной документации в качестве единицы измерения жёсткости используют ммоль экв/л (число миллимоль эквивалента иона кальция или магния, содержащихся в 1 литре воды)*. Молярная масса кальция составляет 40,08 г/моль. Молярная масса моля эквивалента кальция вдвое меньше (20,04 г/моль), так как заряд иона кальция равен +2 (о понятии химического эквивалента см. далее в разделе «1.4.1. Титриметрический метод анализа»). Соответственно, масса одного миллимоля эквивалента кальция равна 20,04 мг. Аналогичный расчет можно провести для двухвалентного иона магния (MMg2+ = 24,32 г/моль). Таким образом, величина жёсткости 1 ммоль экв/л соответствует содержанию 20,04 мг/л иона Ca2+ или 12,16 мг/л иона Mg2+.
Если содержание ионов кальция и магния было найдено другими методами, общую жёсткость воды Жобщ (ммоль экв/л) можно вычислить по формуле:
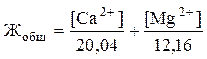 .
.
Различные страны используют свои условные единицы жёсткости. За рубежом в литературе и технической документации для характеристики содержания ионов кальция или магния используют так называемые «градусы жёсткости», пересчет которых в моль экв/л здесь мы не рассматриваем.
Жёсткость природной воды колеблется в широких пределах: она различна в разных водах, а в одном и том же водоисточнике её величина изменяется по временам года.
По величине общей жёсткости воду делят на 5 групп:
| Характеристика воды | Общая жёсткость, ммоль экв/л |
| Очень мягкая | до 1,5 |
| Мягкая | 1,5…3,0 |
| Средней жёсткости | 3,0…5,4 |
| Жесткая | 5, 4…10,7 |
| Очень жесткая | более 10,7 |
Наиболее мягкой является вода атмосферных осадков (0,07…0,10 ммоль экв/л). В качестве примера пресных вод с очень высокой жёсткостью приводят воды Донбасса, формирующиеся в окружении меловых и доломитных пород (18…20 ммоль экв/л). Еще выше жёсткость океанской воды — 130 ммоль экв/л. Жёсткость воды хозяйственно-питьевых водопроводов не должна превышать 7 ммоль экв/л.
Процесс, приводящий к снижению жёсткости, т.е. к уменьшению концентрации ионов Ca2+ и Mg2+ в воде, называется умягчением. Различают следующие методы умягчения:
— методы осаждения;
— методы ионного обмена.
Дата добавления: 2015-09-14; просмотров: 813;
