Уравнение электродного потенциала (уравнение Нернста)
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов:
1) от природы веществ — участников электродного процесса;
2) от соотношения между концентрациями (активностями) этих веществ;
3) от температуры системы.
При стандартных условиях (температура 298 К или 25 °С, давление 101,3 кПа или 1атм, молярная концентрация раствора электролита 1 моль/л) потенциалы электродов имеют определенные стандартные значения. Если концентрация электролита или температура отличны от стандартных, электродные потенциалы можно рассчитать, исходя из стандартных потенциалов, по уравнению Нернста:
ЕOx/Red = Е0Ox/Red+ 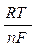 ln
ln 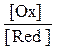 , (2)
, (2)
где Т — абсолютная температура (273 + t), К; F — число Фарадея (96485 Кл/моль); n — число электронов, участвующих в реакции окисления-восстановления; [Ох] — концентрация окисленной формы (для металлического электрода это концентрация ионов металла в растворе), моль/л; [Red] — концентрация восстановленной формы; R — универсальная газовая постоянная (8,314 Дж/моль град).
При температуре 25 °С и условии, что восстановленная форма представляет металл в элементарном состоянии, можно пользоваться следующим уравнением
ЕOx/Red = Е0Ox/Red+ 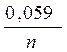 lgСOx , (3)
lgСOx , (3)
где СOx — концентрация ионов металла в растворе, моль/л.
Пример. Вычислить ЭДС гальванического элемента, образованного цинковым электродом, погруженным в 0,01М раствор нитрата цинка Zn(NO3)2, и серебряным электродом, погруженным в 0,001М раствор нитрата серебра AgNO3. Температура 25 °С. Дать схематическую запись элемента и записать электродные процессы, протекающие на катоде и аноде.
Решение. Сравнивая стандартные потенциалы восстановления цинка и серебра, получаем, что катодом в указанном гальваническом элементе будет выступать серебряный электрод, а анодом — цинковый.
Схематическая запись данного гальванического элемента:
Zn │ Zn(NO3)2 ║ AgNO3 │ Ag .
Анодный процесс: Zn 0 – 2ē → Zn2+.
Катодный процесс: Ag+ + ē → Ag0.
ЭДС гальванического элемента рассчитываем по формуле (1), а потенциалы катода и анода по уравнению Нернста в упрощенном виде (3):
ЕZn2+/Zn0= – 0,762 + 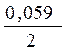 lg0,01= – 0,82 B
lg0,01= – 0,82 B
ЕAg+/Ag0= – 0,90 + 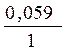 lg0,001= + 0,62 B
lg0,001= + 0,62 B
ЭДС= 0,62 – (–0,82) = 1,44 В.
Дата добавления: 2015-09-14; просмотров: 1268;
