Опыт 6. Получение комплексных соединений кобальта
К 1-2 мл раствора соли кобальта (II) прилить такой же объем концентрированного раствора KSCN. Образуется комплексная соль кобальта, раствор которой имеет синюю окраску.
Требование к результату опыта:
Составить уравнение реакции образования комплексной соли кобальта, учитывая, что координационное число кобальта равно 4.
Опыт 7. Получение комплексных соединений никеля
Налить в пробирку 1-2 мл раствора соли никеля (II), прилить растворNH4OH до образования осадка основной соли. К полученному осадку прилитьизбыток гидроксида аммония до растворения осадка. Наблюдать образование сине-фиолетового раствора аммиаката никеля.
Требования к результатам опыта:
1. Составить уравнение реакции образования основной соли никеля (II).
2. Составить уравнение реакции образования комплексной соли никеля, учитывая, что координационное число никеля равно 4.
Задачи
№ 22.1. Закончить уравнения реакций: а) Fe + H2SO4 (разб.) =;
б) Fe + HNO3 (оч. разб.) =; в) Ni + H2SO4 (конц.) =; г) Co + HCl =
№22.2. Написать в молекулярном и ионном виде уравнения реакций взаимодействия гидроксидов железа (II), кобальта (II) и никеля (III) с соляной кислотой.
№ 22.3. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCl3
№ 22.4. Могут ли в растворе существовать совместно следующие вещества:
а) FeCl3 и SnCl2; б) FeSO4 и NaOH;
в) FeCl3 и K3[Fe(CN)6; г) FeSO4 и K3[Fe(CN)6?
Для взаимодействующих веществ составить уравнения реакций.
№ 22.5. Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4 + CO = 3FeO + CO2.
Вычислить 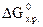 и сделать вывод о возможности самопроизвольного протекания этой реакции при 298 К. В каком направлении сместится равновесие этой реакции при повышении температуры? (
и сделать вывод о возможности самопроизвольного протекания этой реакции при 298 К. В каком направлении сместится равновесие этой реакции при повышении температуры? ( 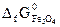 = -1014,2 кДж/моль;
= -1014,2 кДж/моль;
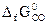 = -137,1 кДж/моль;
= -137,1 кДж/моль; 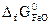 = -244,3 кДж/моль;
= -244,3 кДж/моль;
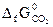 = -394,4 кДж/моль). (Ответ: 24 кДж).
= -394,4 кДж/моль). (Ответ: 24 кДж).
№ 22.6. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeСl2 → Fe(CN)2 → K4[Fe(CN)6] → K3[Fe(CN)6]
№ 22.7. Закончить уравнения реакций: а) Fe(OH)2 + O2 + H2O =;
б) Fe(OH)3 + HCl =; в) Co(OH)3 + HCl =; г) Ni(OH)3 + HCl =
№ 22.8. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Ni → Ni(NO3)2 → Ni(OH)2 → Ni(OH)3 → NiCl2
№ 22.9. Какие степени окисления проявляет железо в своих соединениях? Как можно обнаружить ионы Fe2+ и Fe3+ в растворе? Составить молекулярные и ионные уравнения соответствующих реакций.
№ 22.10. Написать в молекулярном и ионном виде уравнения реакций гидролиза солей: а) FeCl2 + H2O ↔; б) NiSO4 + H2O ↔;
в) Co(NO3)2 + H2O ↔; г) Fe2(SO4)3 + H2O ↔.
№ 22.11. Закончить уравнения реакций получения феррата калия и бария (K2FeO4, BaFeO4): а) KOH + FeCl3 + Br2 = K2FeO4 + ….;
б) K2FeO4 + BaCl2 =; в) Fe2O3 + KNO3 + KOH = KNO2 +…
№ 22.12. Закончить уравнения реакций образования комплексных соединений и назвать их, учитывая, что координационное число железа равно 6, а кобальта и никеля 4. а) Fe(CN)2 + KCN =; б) Co(SCN)2 + NH4SCN (избыток) =;
в) NiSO4 + NH4OH (избыток) =
№ 22.13. Сколько часов надо вести электролиз раствора FeSO4, чтобы при силе тока в 2 А выделилось 279,2 г чистого железа? (Ответ: 133,6 ч).
№ 22.14. Рассчитать молярную массу эквивалентов и эквивалент восстановителя в реакции: Fe(OH)2 + KMnO4 + H2O =
№ 22.15. Определить тепловой эффект реакции
4FeS2 + 11O2 = 2Fe2O3 + 8SO2,
если в реакции участвует 59,2 г FeS2, а энтальпии образования реагирующих веществ равны: 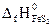 = -148,5 кДж/моль;
= -148,5 кДж/моль; 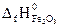 = -803,3 кДж/моль;
= -803,3 кДж/моль;
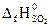 = -297,4 кДж/моль. (Ответ: -418,3 кДж).
= -297,4 кДж/моль. (Ответ: -418,3 кДж).
№ 22.16. Состав комплексной соли кобальта выражается эмпирической формулой CoCl3 ∙ 4NH3. При взаимодействии с нитратом серебра осаждается лишь одна треть содержащегося в соли хлора. Учитывая, что координационное число кобальта в этом соединении 6, определить, какие лиганды входят в состав комплексного иона и написать координационную формулу соли.
№ 22.17. Вычислить тепловой эффект реакции, протекающей при выплавке чугуна, по стандартным энтальпиям образования веществ
3Fe2O3 + CO = 2Fe3O4 + CO2.
( 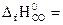 -110,5 кДж/моль;
-110,5 кДж/моль; 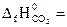 -393,5 кДж/моль;
-393,5 кДж/моль; 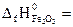 -822,2 кДж/моль;
-822,2 кДж/моль; 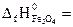 -1117,1 кДж/моль). (Ответ: -50,6 кДж).
-1117,1 кДж/моль). (Ответ: -50,6 кДж).
№ 22.18. Закончить в молекулярном и ионном виде уравнения качественных реакций на ион Fe3+:
а) Fe2(SO4)3 + KOH =; б) FeCl3 + K4[Fe(CN)6] =; в) Fe(NO3)3 + KSCN =
№ 22.19. Закончить уравнения реакций:
а) FeSO4 + Br2 + H2SO4 =; б) FeCl3 + H2S =;
в) FeCl3 + Na2CO3 + H2O =; г) Fe + HNO3(разб) =
№ 22.20. Как влияет на коррозию железа его контакт с другими металлами? Какой металл будет разрушаться первым при повреждении поверхности а) луженого, б) оцинкованного; в) никелированного железа? Составить схемы образующихся гальванических элементов. Написать уравнения реакций катодных и анодных процессов.
Дата добавления: 2015-09-11; просмотров: 1528;
