Выполнение работы. Опыт 1. Получение и свойства гидроксида марганца (II)
Опыт 1. Получение и свойства гидроксида марганца (II)
В две пробирки налить по 1-2 мл раствора соли марганца (II) и в каждую добавить по каплям раствор щёлочи до образования осадка. Отметить его цвет. В одну из пробирок прилить раствор кислоты, другую оставить на воздухе и наблюдать изменение цвета осадка. Осадок сохранить для опыта 3.
Требования к результатам опыта:
1. Составить уравнение реакции образования Mn(ОН)2.
2. Написать уравнение реакции растворения гидроксида марганца (II) в кислоте.
3. Написать уравнение реакции окисления гидроксида марганца (II) на воздухе до MnО(ОН)2
4. Сделать вывод о кислотно-основных свойствах Mn(ОН)2.
Опыт 2. Восстановительные свойства соединений марганца (II)
В пробирку налить 2-3 мл раствора азотной кислоты (1:1) и 2-3 капли раствора MnSO4, перемешать и на кончике шпателя добавить висмутата натрия NaBiO3. По изменению окраски раствора определить образовавшееся соединение.
Требования к результатам опыта:
1. Закончить уравнение реакции: MnSO4 + NaBiO3 + HNO3 =
2. Сделать вывод, какие свойства, окислительные или восстановительные, проявляют соединения марганца (II).
Опыт 3. Окислительные свойства соединений марганца (IV)
Приготовить 2-3 мл раствора сульфата железа (II), подкислить его 1-2 мл разбавленной H2SO4 и добавить к осадку, полученному в опыте 1. Что наблюдается?
Требования к результатам опыта:
1. Составить уравнение реакции взаимодействия MnО(ОН)2 с FeSO4 в кислой среде.
2. Сделать вывод, какие свойства, окислительные или восстановительные, проявляют соединения марганца (IV) в данной реакции.
Опыт 4. Разложение перманганата калия
В сухую пробирку поместить шпатель перманганата калия и нагреть на пламени спиртовки. К отверстию пробирки поднести тлеющую лучинку. Что наблюдается? Какой газ выделяется при разложении KМnO4? Нагревание продолжить до прекращения выделения газа. Пробирку охладить и влить в неё 2-3 мл воды. По окраске образовавшегося раствора и осадка определить соединения.
Требования к результатам опыта:
1. Составить уравнение реакции разложения KМnO4 при нагревании и сделать вывод, к какому типу ОВР относится данная реакция.
2. Закончить уравнение реакции K2МnO4 + Н2О = и сделать вывод, к какому типу ОВР относится данная реакция.
Опыт 5. Окислительные свойства соединений марганца (VII)
Окисление пероксида водорода
Налить в пробирку 1-2 мл раствора KМnO4, 0,5-1 мл раствора H2SO4 и 2-3 мл раствора пероксида водорода Н2O2. Отметить обесцвечивание раствора и выделение газа.
Окисление сульфата марганца (II)
К 1-2 мл раствора сульфата марганца MnSO4 по каплям прилить раствор перманганата калия до выделения бурого осадка MnO2. При помощи универсальной индикаторной бумаги убедиться, что реакция раствора стала кислой.
Требования к результатам опыта:
1. Закончить уравнения реакций: KМnO4 +Н2O2 + H2SO4 =;
MnSO4 + KМnO4 + Н2О=
2. Сделать вывод, какие свойства, окислительные или восстановительные, проявляют соединения марганца (VII).
Опыт 6. Влияние среды на характер восстановления перманганата калия
В три пробирки налить по 2-3 мл раствора перманганата калия и добавить: в первую – 1-2 мл раствора H2SO4, во вторую – столько же воды, а в третью 1-2 мл концентрированной щёлочи. Во все три пробирки добавить по каплям раствор нитрита калия КNO2 до исчезновения фиолетового окрашивания. По окраскам полученных растворов и осадков определить соединения марганца.
Требования к результатам опыта:
1. Закончить уравнения реакций:
KМnO4 + КNO2 + H2SO4 =;
KМnO4 + КNO2 + Н2О =;
KМnO4 + КNO2 + КОН =
2. Сделать вывод о характерной степени окисления марганца в кислой, нейтральной и щелочной среде.
Задачи
№ 21.1. Как получить сульфат марганца (II) из: а) оксида марганца (II);
б) металлического марганца; в) KMnO4? Составить соответствующие уравнения реакций.
№ 21.2. Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4 в кислой среде? (Ответ: 1,58 г).
№ 21.3. Рассчитать молярную массу эквивалентов перманганата калия в реакции: KMnO4 + PH3 + H2SO4 = H3PO4 + …..
Какая масса H3PO4 образуется, если в реакции участвовало 17 г PH3?
(Ответ: 31,6 г/моль; 49 г).
№ 21.4. Под действием HNO3 манганаты диспропорционируют следующим образом: K2MnO4 + HNO3 = KMnO4 + MnO2 + KNO3 + H2O
Какой объем раствора HNO3 (ρ = 1,185 г/мл) с массовой долей 30 % необходим для того, чтобы получить 9,48 г перманганата калия? (Ответ: 21,3 мл).
№ 21.5. Как получить соединения марганца (VI) из соединений с более высокой и с более низкой степенью окисления? Составить соответствующие уравнения реакций.
№ 21.6. Окисление сульфата железа (II) перманганатом калия в нейтральной среде протекает по уравнению KMnO4 + FeSO4 + Н2О = FeОНSO4 + ……
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4?
(Ответ: 2,63 г).
№ 21.7. Закончить уравнения реакций: а) MnO + H2SO4 =;
б) Mn2O7 + KOH =; в) MnSO4 + KClO3 + KOH 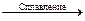 K2MnO4 + …
K2MnO4 + …
№ 21.8. Закончить уравнения реакций, в которых соединения марганца проявляют свойства: а) окислительные Fe(OH)2 + KMnO4 + H2O =;
б) восстановительные MnSO4 + PbO2 + HNO3 =;
в) окислительные и восстановительные одновременно K2MnO4 + H2O =
№ 21.9. Почему оксид марганца (IV) может проявлять и окислительные и восстановительные свойства? Закончить уравнения реакций:
а) MnO2 + KI + H2SO4 =; б) MnO2 + KNO3 + KOH =
№ 21.10. Как меняется степень окисления марганца при восстановлении KMnO4 в кислой, щелочной и нейтральной среде? Закончить уравнения реакций: а) KMnO4 + К2SO3 + H2SO4 =;
б) KMnO4 + К2SO3 + КОН =; в) KMnO4 + К2SO3 + H2O =
№ 21.11. Восстановление перманганата калия сульфатом железа (II) в кислой среде протекает по уравнению KMnO4 + FeSO4 + H2SO4 =…. На восстановление KMnO4 израсходовано 47 мл 0,208 н раствора FeSO4. Сколько граммов KMnO4 содержалось в исходном растворе? (Ответ: 0,154 г).
№ 21.12. Закончить уравнения реакций: а) Mn + H2SO4 (разб.) =;
б) MnCl2 + KOH =; в) MnCl2 + H2O ↔; г) Mn + HNO3 (разб.) =
№ 21.13. Окисление сульфата железа (II) перманганатом калия в щелочной среде протекает по уравнению KMnO4 + FeSO4 + КОН = FeОНSO4 + ……
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4?
(Ответ: 7,9 г).
№ 21.14. Можно ли восстановить марганец из его оксида алюминием? Ответ мотивировать, вычислив ΔG0 реакции: 3MnO2 + 4Al = 2Al2O3 + 3Mn
( 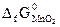 = -464,8 кДж/моль;
= -464,8 кДж/моль; 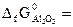 -1582 кДж/моль).
-1582 кДж/моль).
№ 21.15. Как можно перевести в растворимое состояние марганец? Составить соответствующие уравнения реакций.
№ 21.16. Вычислить молярную массу эквивалентов и эквивалент окислителя в реакции: NaNO2 + KMnO4 + H2SO4 =
№ 21.17. Вычислить тепловой эффект реакции получения марганца по стандартным энтальпиям образования: 3MnO2 + 4Al = 2Al2O3 + 3Mn
( 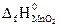 -519,4 кДж/моль;
-519,4 кДж/моль; 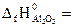 -1676 кДж/моль). (Ответ: -1793,8 кДж).
-1676 кДж/моль). (Ответ: -1793,8 кДж).
№ 21.18. Закончить уравнения реакций: а) KMnO4 + H2SO4 (конц.) =;
б) Mn2O7 + HCl =; в) Mn2O7 + NaOH =; г) MnO2 + KOH =
№ 21.19. За 10 мин из раствора MnSO4 ток силой 5 А выделил 0,85 г Mn. Определить молярную массу эквивалентов марганца. (Ответ: 27,3 г/моль).
№ 21.20. Закончить уравнения реакций: а) K2MnO4 + Cl2 =;
б) Mn(NO3)2 + H2O ↔; в) MnSO4 + H2O ↔; г) MnCl2 + NaOH =.
Реакции б), в), г) написать в молекулярном и ионном виде.
Дата добавления: 2015-09-11; просмотров: 2797;
