Химические свойства. Наличие в молекулах алкенов двойной связи, состоящей из - и - связей, предопределяет их повышенную реакционную способность в реакциях присоединения
Наличие в молекулах алкенов двойной связи, состоящей из 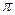 - и
- и 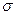 - связей, предопределяет их повышенную реакционную способность в реакциях присоединения, так как
- связей, предопределяет их повышенную реакционную способность в реакциях присоединения, так как 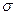 -связь прочнее чем
-связь прочнее чем 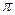 связь.
связь.
Естественно ожидать, что реакции алкенов будут проходить по двойной связи, а следовательно, будут реакциями присоединения, а не реакциями замещения, характерными для ранее рассмотренных алканов.
1. Присоединение водорода. Присоединение водорода к алкенам приводит к образованию предельных углеводородов:
СН3-СН=CH2 + Н2 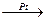 СН3-СН2-CH3
СН3-СН2-CH3
2. Присоединение галогенов. Галогены присоединяются к алкенам с образованием вицинальных дигалогенпроизводных, т. е. содержащих атомы галогена у соседних атомов углерода.
На первой стадии этой реакции происходит взаимодействие между 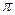 -электронами двойной связи и электрофильной частицей галогена с образованием так называемого
-электронами двойной связи и электрофильной частицей галогена с образованием так называемого 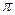 -комплекса I, который через стадию образования карбкатиона II распадается на продукт реакции III.
-комплекса I, который через стадию образования карбкатиона II распадается на продукт реакции III.
[R-CH=CH-R --- Cl 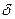 +- Cl
+- Cl 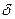 -]
-]  [R-CHCl-CH-R]•Cl-]
[R-CHCl-CH-R]•Cl-]  R-CHCl-CHCl-R
R-CHCl-CHCl-R
I II III
3. Присоединение галогенводородов. Галогенводороды присоединяются к алкенам с образованием галогеналкилов. Присоединение в случае несимметричных молекул идет по правилу Марковникова, т. е. водород присоединяется к наиболее гидрогенизированному атому углерода (с наибольшим числом водородных атомов):
R-CH=CR2 + HBr  R-CH2-CR2Br
R-CH2-CR2Br
Эта реакция, как и присоединение брома к этилену, идет после образования 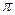 -комплекса через стадию образования соответствующего карбкатиона.
-комплекса через стадию образования соответствующего карбкатиона.
[R-CH=CR2 --- Н 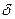 +- Cl
+- Cl 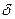 -]
-]  [R-CH2-CR2]+•Cl-
[R-CH2-CR2]+•Cl- 
 R-CH2-CR2Cl
R-CH2-CR2Cl
В присутствии перекисей бромистый водород присоединяется не по правилу Марковникова (эффект Хараша).
В присутствии перекисей реакция идет не по механизму электрофильного присоединения, как выше, а по радикальному механизму (Xapaш). Первой стадией является атака перекисного радикала на молекулу HBr:
RCOO• + HBr  RCOOH + Br•
RCOOH + Br•
Возникший радикал брома может присоединяться к алкену с образованием новых радикалов I и II, в связи с чем, реакция должна протекать по двум направлениям:
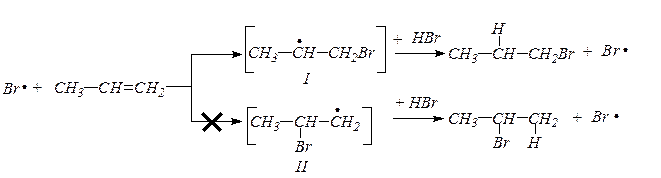
Но направление процесса определяется устойчивостью промежуточных образований-радикалов I и II. Не спаренный электрон более стабилен у вторичного углерода (индукционный эффект), поэтому реакция протекает через промежуточный радикал I.
4. Присоединение воды и серной кислоты. В присутствии кислот вода присоединяется по двойной связи в соответствии с правилом Марковникова:
R-CH=CН2 + H2О 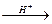 R-CH-CН3
R-CH-CН3
│
ОН
Так же идет и реакция с серной кислотой:
R-CH=CН2 + H2SО4  R-CH-CН3
R-CH-CН3
│ 

OSО3H
5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
3R-CH=CH-R + 2KMnO4 + 4H2O  3R-CH – CH–R+ 2KOH + 2MnO2
3R-CH – CH–R+ 2KOH + 2MnO2
│ │ 
 OH OH
OH OH
Кислые растворы перманганата окисляют алкены с разрывом цепи по С=С связи с образованием кислот или кетонов:
(СН3)2С=СН-СН3 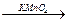 (СН3)2С=O + СН3COOH
(СН3)2С=O + СН3COOH
6. Действие озона на алкены.Действие озона на алкены приводит к образованию кристаллических сильно взрывчатых озонидов, которые при гидролизе образуют альдегиды или кетоны:
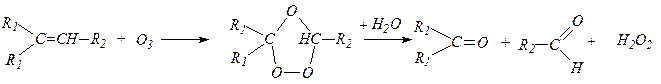
Дата добавления: 2015-09-11; просмотров: 961;
