Получение этилена и его горение
В сухую пробирку помещают несколько крупинок песка, 2 капли этилового спирта и 4 капли концентрированной серной кислоты. Закрывают пробирку пробкой с газоотводной трубкой и осторожно нагревают смесь на пламени горелки. Выделяющийся газ поджигают у конца газоотводной трубки — он горит светящимся пламенем.
Химизм процесса:
CНз-СН2ОН + НОSОзН  СНз-СН2-OSОзН + Н2О
СНз-СН2-OSОзН + Н2О
этилсерная кислота
Этилсерная кислота — моноэфир неорганической двухосновной кислоты — при нагревании разлагается:
СНз-СН2-OSOзН  СН2=СН2 + H2SO4
СН2=СН2 + H2SO4
Таким образом, при взаимодействии этилового спирта с серной кислотой происходит дегидратация спирта:
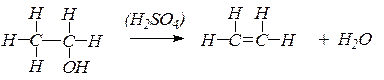
Выделяющийся этилен горит светящимся пламенем:
C2H4 + ЗO2  2СO2 + 2Н2О
2СO2 + 2Н2О
Концентрированная серная кислота является окислителем. При нагревании смеси спирта с концентрированной серной кислотой образуется, кроме этилена и следов диэтилового эфира (СзН5)2О, ряд продуктов окисления органических соединений, например СО2, уголь С (обычно смесь в пробирке чернеет). Серная кислота при этом восстанавливается углеродом до сернистого ангидрида:
2H2SO4 + С  СО2 + 2SO2 + 2H2O
СО2 + 2SO2 + 2H2O
Сернистый ангидрид также может обесцвечивать растворы брома и марганцевокислого калия подобно этилену. Поэтому образующийся этилен промывают раствором щелочи для очистки от SO2. Если реакцию вести в присутствии песка, сульфата алюминия (катализаторы, ускоряющие дегидратацию спирта), почернения смеси не происходит, следовательно, сернистый ангидрид не образуется.
Дегидратация спиртов является общим способом получения непредельных углеводородов.
Дата добавления: 2015-09-11; просмотров: 5083;
