Структура РНК-полімерази
Дві субодиниці α взаємодіють між собою в складі коферменту бактеріальної РНК-полімерази (рис. 2), виконуючи структурну роль: вони сприяють утриманню разом інших частин ферменту. Дві великі субодиниці – β і β’ – формують характерні щелепи (форма нагадує також клішню краба), у щілині між якими з ферментом взаємодіє ДНК, розташована нижче (down stream) у напрямку руху полімерази від точки, яка в даний момент знаходиться в активному центрі. Щелепи є рухливими елементами, здатними розмикатися /замикатися під час роботи полімерази. Глибоко в щілині між щелепами, ліворуч від F-спіралі (F-bridge helix), що зображена на рис. 2 (належить до найбільшої субодиниці β’), розташований каталітичний активний центр: 3 залишки Asp (також належать до β’), що утримують ключовий для каталізу іон Mg2+ (рис. 3).

Рис. 2. Структура РНК-полімерази Thermus thermophilus (1IW7).
Структурні елементи, які оточують активний центр, забезпечують взаємодію полімерази з нематричним ланцюгом ДНК (підтримуючи його розплавлений стан), дволанцюговим гібридом ДНК-РНК, сприяють поділу подвійної спіралі ДНК нижче від активного центру, поділу подвійної спіралі ДНК-РНК гібрида та відновленню подвійної спіралі ДНК вище (up stream) активного центру. Від активного центру, де міститься 3′-кінець РНК, що зростає, РНК виходить за межі полімеразного комплексу через спеціальний канал. Інший, так званий вторинний канал, дозволяє нуклеозидтрифосфатам потрапляти до точки зростання РНК. Загальну схему будови полімерази в комплексі з ДНК і РНК під час елонгації транскрипції наведено на рис. 4.
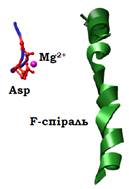
Рис. 3. Активний центр поряд із F-спіраллю у складі РНК-полімерази Thermus aquaticus (1HQM). Орієнтація полімерази приблизно така сама, як на рис. 2.
Описані риси структурної організації бактеріальної РНК-полімерази (рухливі щелепи, активний центр з іоном Mg2+, канали для виходу РНК і заходу NTP) є загальними для усіх РНК-полімераз. Це стосується не тільки гомологічних еукаріотичних полімераз. Деякі бактеріофаги (зазвичай фаги використовують полімеразу клітини-хазяїна) мають власні РНК-полімерази, що є мономерними білками без гомології в амінокислотній послідовності до субодиниць бактеріальної полімерази (рис. 5). Простота мономерних полімераз (яка робить їх зручним об’єктом досліджень) зумовлена тим, що вони мають упізнавати лише кілька промоторів фагових генів. Але вказані вище загальні риси структурної організації РНК-полімераз та базові принципи функціонування зберігаються і для них.
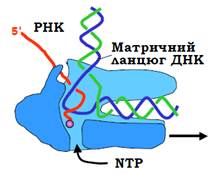
Рис. 4. Схема організації полімеразного комплексу (у розрізі) під час елонгації транскрипції.

Рис. 5. Структура елонгаційного комплексу мономерної РНК-полімерази бактеріофага Т7 (1MSW). Матричний ланцюг ДНК – темносиній, РНК – червона.
У структурі голоферменту бактеріальної РНК-полімерази присутня додаткова субодиниця σ. Вона має мультидоменну структуру (рис. 2) і здійснює різноманітні взаємодії з обома великими субодиницями (β і β'): фіксує певне положення щелеп, взаємодіє з активним центром і його оточенням. Розташування σ-фактора на поверхні полімеразного комплексу дозволяє йому здійснювати впізнання промотора. Крім того,частина σ взаємодіє з каналом виходу РНК (порівн. рис. 2 і 4), блокуючи його: дисоціація σ є необхідною для виходу синтезованої РНК, тобто для вільного руху полімерази вздовж матриці під час елонгації.
Дата добавления: 2015-09-11; просмотров: 1012;
