Посттрансляційні модифікації гістонових хвостів
Невпорядковані хвости корових гістонів є субстратом для ковалентних посттрансляційних модифікацій, яким піддаються конкретні (такі, що мають конкретну позицію у складі поліпептидного ланцюга) амінокислотні залишки певного типу. Основні типи цих модифікацій наведено на рис. 12.
• Ацетилювання залишків Lys – перенесення залишку оцтової кислоти (ацетату) на аміногрупу Lys. Реакція каталізується гістонацетилтрансферазами (HAT, Histone Acetyl Transferase), різні їхні типи мають певну специфічність щодо залишків мішеней. Результатом реакції є зникнення позитивного заряду на залишку Lys (рис. 12). Ацетилювання є динамічною модифікацією: гістондеацетилази (HD, Histone Deacetylase, позначаються також як HDAC) здійснюють відщеплення ацетатних залишків. Два типи ферментів антагоністів підтримують певний динамічний гомеостаз ацетилювання / деацетилювання, зсунутий у той чи інший бік у певних ділянках хроматину.
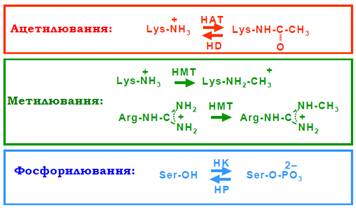
Рис. 12. Посттрансляційні модифікації амінокислотних залишків у гістонах (показано лише хімічні групи у складі залишків, які безпосередньо модифікуються). HAT – гістонацетилтрансфераза, HD – гістондеацетилаза, HMT – гістонметилтрансфераза, HK – гістонкіназа, НР – гістонфосфатаза.
• Метилювання залишків Lys та Arg – перенесення метальної групи (однієї, двох або трьох) на аміногрупу Lys або на гуанідинову групу Arg, позитивний заряд при цьому залишається. Реакція каталізується гістонметилтрансферазами (HMT, Histone Methyl Transferase), кожна з яких є специфічною щодо залишку мішені. На відміну від ацетилювання, метилювання є дуже стабільною у часі модифікацією. Метильовані гістони замінюються на неметильовані дуже повільно – імовірно, лише шляхом заміни на гістони, синтезовані de novo.
• Фосфорилювання залишків Ser – перенесення фосфатного залишку на ОН-групу Ser. Реакція каталізується гістонкіназою (HK, Histone Kinase), відщеплення фосфату – фосфатазою. Конкретні залишки, що модифікуються, показано на рис. 13.
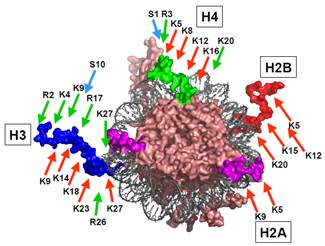
Рис. 13. Кінцеві хвости гістонів у структурі нуклеосоми (1KX5) та їхні модифікації. Кольором виділено по одному N-кінцевому хвосту кожного гістону, а також С-кінцевий – гістону Н2А (поряд із Nкінцем Н3). Стрілочками вказано ацетилювання (червоні), метилювання (зелені) і фосфорилювання (блакитні) залишків певного типу, які займають певні позиції в поліпептидних ланцюгах.
Серед усіх модифікацій, лише про ацетилювання можна сказати, що воно чітко корелює з транскрипційною активністю: гіперацетильовані гістони присутні в активних ділянках хроматину, у репресованих підтримується деацетильований статус. Інші модифікації впливають на функціональний стан складніше: метилювання одного залишку може викликати репресію транскрипції, іншого (через кілька амінокислот від першого в тому самому хвості) – супроводжувати активацію; фосфорилювання H3Ser10 корелює з активацією транскрипції, але також супроводжує гіперконденсацію хроматину при переході до мітозу.
Оскільки ацетилювання численних залишків Lys (рис. 13) приводить до суттєвого пониження позитивного заряду хвостів, лише ацетилювання може безпосередньо впливати на взаємодію хвостів із ДНК. Це не викликає змін структури нуклеосоми (яка практично не залежить від хвостів), але змінює характер структурної динаміки як нуклеосоми, так і хроматинової фібрили на наднуклеосомному рівні її організації.
Однак головним механізмом впливу модифікованих гістонових хвостів на функціональний стан хроматину є специфічне впізнання модифікованих хвостів іншими білками: регуляторами, факторами транскрипції, ферментами тощо. Так, ацетильовані залишки Lys упізнаються особливим структурним блоком таких білків – бромодоменом.
Інший блок – хромодомен – упізнає метильовані Lys. Гістонові хвости слугують своєрідними платформами для збирання різноманітних білкових комплексів, склад яких залежить від патерну модифікацій розподілу певних модифікованих груп по хвостах. Співвідношення між патерном модифікацій і набором білків, які впізнають такий патерн, що у свою чергу має певні функціональні наслідки, називають гістоновим кодом.
Наприклад, фосфорилювання Н3Ser10 із одночасним ацетилюванням Н3Lys14 супроводжується активацією транскрипції, деацетилювання Н3Lys14 із одночасним метилюванням Н3Lys9 – репресією. Це лише невеличкий елемент такого коду: зрозуміло, що різноманітних комбінації модифікованих залишків на восьми гістонових хвостах (рис. 13) може бути велика кількість. Остаточне з’ясування гістонового коду ще далеко не завершено.
Дата добавления: 2015-09-11; просмотров: 1861;
