Електроліз.
Під час пропускання постійного електричного струму крізь розчин або розплав електроліту на електродах відбуваються окисно – відновні процеси перетворення складових електрохімічної системи на продукти їх окиснення та відновлення.
Електроліз складається з:
ü катодного процесу, який відбувається на негативно зарядженому електроді. На катоді зосереджуються електрони, які він віддає на відновлення частинок – окисників розчину або розплаву електроліту.
ü анодного процесу, який відбувається на позитивно зарядженому електроді. На аноді окиснюються частинки – відновники, віддаючи йому свої електрони.
Обидва процеси пов’язані між собою – скільки електронів приймають частинки на катоді під час відновлення, стільки електронів віддають частинки під час окиснення на аноді.
Розглянемо електроліз розплаву йодиду калію з інертними електродами. У розплаві йодид калію перебуває у дисоційованому стані:
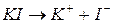
Під час електролізу катіони 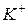 переміщуються до катода, а аніони
переміщуються до катода, а аніони 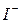 - до анода.
- до анода.
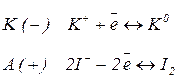
Отже під час електролізу розплаву йодиду калію на катоді виділяється металічний калій, на аноді – вільний йод.
Розглянемо електроліз водного розчину йодиду калію з інертними електродами. У водному розчині йодид калію перебуває у дисоційованому стані:
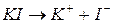
Складемо послідовні електродно-йонні рівняння напівреакцій, які можуть відбуватися на електродах, і зазначимо відповідні їм електродні потенціали. Порівняємо окремо потенціали частинок в катодному та анодному просторі між собою і виберемо найімовірніший процес:
Катод (-)
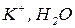


Анод (+)


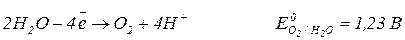
На катоді відбувається процес відновлення окисників. Чим більший електродний потенціал напівреакції, тим сильнішим окисником є частинка. Отже, на катоді проходить процес з більшим електродним потенціалом.
На аноді відбувається процес окиснення відновників. Чим менший електродний потенціал напівреакції, тим ефективнішим відновником є частинка. Отже, на аноді проходить процес з меншим електродним потенціалом.
Розглянемо електроліз водного розчину сульфату нікелю з інертними електродами. У водному розчині сульфат нікелю перебуває у дисоційованому стані:
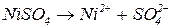
Складемо послідовні електродно-йонні рівняння напівреакцій, які можуть відбуватися на електродах, і зазначимо відповідні їм електродні потенціали. Порівняємо окремо потенціали частинок в катодному та анодному просторі між собою і виберемо найімовірніший процес:
Катод (-)
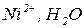


Анод (+)
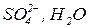

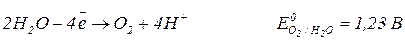
Розглянемо електроліз водного розчину сульфату нікелю з нікелевим анодом. У водному розчині сульфат нікелю перебуває у дисоційованому стані:
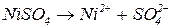
Складемо послідовні електродно-йонні рівняння напівреакцій, які можуть відбуватися на електродах, і зазначимо відповідні їм електродні потенціали. Порівняємо окремо потенціали частинок в катодному та анодному просторі між собою і виберемо найімовірніший процес:
Катод (-)
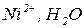


Анод (+)


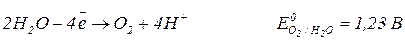

Отже, електроліз водного розчину сульфату нікелю з нікелевим анодом полягає в розчиненні матеріалу анода (нікелю) та відновлення йонів нікелю на катоді.
Закони Фарадея
(кількісні закони електролізу).
Перший закон:
маса речовини, що утворилась внаслідок електролізу, прямо пропорційна кількості пропущеного крізь систему електричного струму
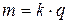
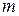 - маса речовини, що виділилась на електроді;
- маса речовини, що виділилась на електроді;
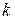 - коефіцієнт пропорційності, електрохімічний еквівалент;
- коефіцієнт пропорційності, електрохімічний еквівалент;
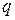 - кількіст електрики.
- кількіст електрики.
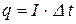
 - сила струму;
- сила струму;
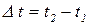 - тривалість процесу електролізу.
- тривалість процесу електролізу.

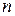 - кількість еквівалентів речовини;
- кількість еквівалентів речовини;
 - стала Фарадея.
- стала Фарадея.
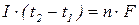
 ;
;
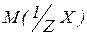 - молярна маса еквівалентів.
- молярна маса еквівалентів.
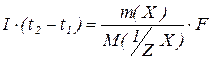
Другий закон:
маси різних речовин, які утворилися внаслідок пропускання однієї й тієї самої кількості електричного струму, відносяться між собою, як їх еквівалентні маси.
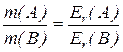
Дата добавления: 2015-09-02; просмотров: 1097;
