Гальванічні елементи.
Процеси окиснення і відновлення, які завжди відбуваються одночасно, можна провести за відсутності безпосереднього контакту між відновником та окисником, тобто в умовах просторового їх розділення. При цьому електрони переходять від відновника до окисника не безпосередньо, а через металічний провідник, створюючи електричний струм.
Гальванічні елементи – пристрої, призначені для безпосереднього перетворення енергії хімічної реакції на електричну.
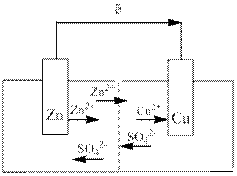
Гальванічний елемент Даніеля – Якобі складається з цинкової пластини, зануреної у розчин 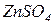 , та мідної пластини, зануреної у розчин
, та мідної пластини, зануреної у розчин 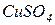 . Розчини електролітів (
. Розчини електролітів ( 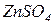 ,
, 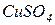 ) розділяють електрохімічним ключем, який перешкоджає їхньому змішуванню, але забезпечує можливість переходу іонів з одного розчину в інший.
) розділяють електрохімічним ключем, який перешкоджає їхньому змішуванню, але забезпечує можливість переходу іонів з одного розчину в інший.
Якщо зовнішнє коло розімкнене, цинковий та мідний електроди перебувають у стані рівноваги:

Внаслідок цього на них виникають подвійні електричні шари і певні електродні потенціали. Ці потенціали різні, оскільки здатність віддавати електрони і переходити в розчин цинку та міді не однакова. Більш здатний до віддавання електронів цинк.
Якщо електроди з’єднати металічним провідником, електрони почнуть переходити з більш негативного цинкового електрода на мідний. Це спричинює зміщення рівноваги:

При замкненому зовнішньому колі в гальванічному елементі окислюється металічний цинк (утворені іони цинку переходять у розчин), на мідному електроді відбувається відновлення іонів міді (осаджується металічна мідь).
Сумарне рівняння окисно – відновної реакції, яка є джерелом електричного струму:

Внаслідок перебігу процесів на цинковому електроді катіони 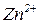 переходять у розчин і створюють у ньому надлишковий позитивний заряд, а біля мідного розчин, навпаки, збіднюється на катіони міді
переходять у розчин і створюють у ньому надлишковий позитивний заряд, а біля мідного розчин, навпаки, збіднюється на катіони міді 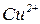 і має негативний заряд (за рахунок аніонів
і має негативний заряд (за рахунок аніонів 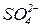 ). Електричне поле, що виникає, спричинює рух катіонів розчину (
). Електричне поле, що виникає, спричинює рух катіонів розчину ( 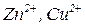 ) до мідного електрода, а аніонів (
) до мідного електрода, а аніонів ( 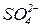 ) – від мідного електрода до цинкового. Внаслідок такого переміщення зарядів розчини біля електродів залишаються електронейтральними.
) – від мідного електрода до цинкового. Внаслідок такого переміщення зарядів розчини біля електродів залишаються електронейтральними.
Під час роботи гальванічного елемента електричний струм у зовнішньому колі створюється спрямованим рухом електронів, у внутрішньому – іонів.
У будь – якій електрохімічній системі назви електродів визначають за характером окисно – відновних процесів, які на них відбуваються.
Анод – електрод, на якому відбувається процес окиснення і який надсилає електрони в зовнішнє коло елемента.
У гальванічному елементі він має негативний заряд.
Катод – електрод, на якому відбувається процес відновлення, і який приєднує електрони.
У гальванічному елементі він має негативний заряд.
Схема роботи гальванічного елемента Даніеля – Якобі:
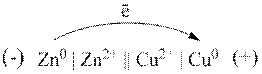
Електрорушійна сила ( 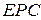 ) – сила, завдяки якій відбувається переміщення електронів у зовнішньому колі елемента. Для точного вимірювання ЕРС гальванічного елемента потрібні спеціальні пристрої і такі умови, щоб у ньому практично не створювався електричний струм. Корисна робота, яку можна виконати за рахунок енергії хімічної реакції, залежить від її швидкості: вона максимальна в разі повільного, оборотнього перебігу реакції. Отже, корисна робота гальванічного елемента залежить від сили струму, який від нього відбирають. Цього досягають збільшенням опору вимірювального приладу. Тоді силу струму можна зменшити до мінімуму, швидкість реакції буде нескінченно малою, корисна робота – максимальною.
) – сила, завдяки якій відбувається переміщення електронів у зовнішньому колі елемента. Для точного вимірювання ЕРС гальванічного елемента потрібні спеціальні пристрої і такі умови, щоб у ньому практично не створювався електричний струм. Корисна робота, яку можна виконати за рахунок енергії хімічної реакції, залежить від її швидкості: вона максимальна в разі повільного, оборотнього перебігу реакції. Отже, корисна робота гальванічного елемента залежить від сили струму, який від нього відбирають. Цього досягають збільшенням опору вимірювального приладу. Тоді силу струму можна зменшити до мінімуму, швидкість реакції буде нескінченно малою, корисна робота – максимальною.
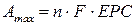
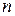 - кількість електронів;
- кількість електронів;
 - стала Фарадея.(
- стала Фарадея.(  , заряд 1 моль електронів, оскільки для окиснення або відновлення 1 моль еквівалентів будь – яких частинок потрібно віддати або приєднати 1 моль електронів).
, заряд 1 моль електронів, оскільки для окиснення або відновлення 1 моль еквівалентів будь – яких частинок потрібно віддати або приєднати 1 моль електронів).
За сталих температури і тиску максимальна корисна робота
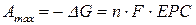
Отже, ЕРС гальванічного елемента характеризує максимальну корисну роботу, яку може виконати система в разі оборотнього перебігу в ній даної хімічної реакції.
Якщо концентрації речовин, які беруть участь у реакції за стандартних умов дорівнюють 1 моль/л, то ЕРС елемента називають його стандартною електрорушійною силою 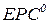 :
:

Рівняння, що відображає зв’язок стандартної електрорушійної сили гальванічного елемента з константою рівноваги його окисно – відновної реакції:
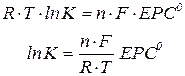
ЕРС гальванічного елемента визначають як різницю електродних потенціалів:
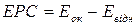
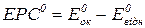
Дата добавления: 2015-09-02; просмотров: 975;
