Слабкі електроліти.
Слабкі електроліти дисоціюють частково та оборотньо – у розчині одночасно містяться недисоційовані молекули та іони. Між молекулами та іонами встановлюється рівновага, яка характеризується константою рівноваги, яку називають константою електролітичної дисоціації.
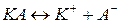
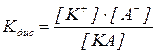
Константа електролітичної дисоціації залежить від природи електроліту та розчинника, а також від температури, і не залежить від концентрації електроліту та його іонів у розчині.
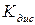 є характерною величиною для даних електроліту та розчинника і залежить лише від температури. Вона кількісно визначає здатність електроліту до дисоціації на іони і характеризує його силу: чим більша
є характерною величиною для даних електроліту та розчинника і залежить лише від температури. Вона кількісно визначає здатність електроліту до дисоціації на іони і характеризує його силу: чим більша 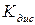 , тим повніше дисоціює електроліт і тим він сильніший.
, тим повніше дисоціює електроліт і тим він сильніший.
Для характеристики дисоціації слабкого електроліту використовують також ступінь дисоціації  . Значення
. Значення 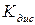 ,
, 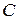 та
та  зв’язані між собою:
зв’язані між собою:
 ;
;
для бінарного електроліту 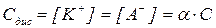 ;
;
тоді рівноважна концентрація недисоційованих молекул 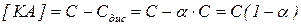 .
.
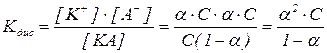
Це рівняння дістало назву закону розведення Оствальда. Суть його полягає в тому. Що в разі розбавлення розчину його концентрація 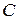 зменшується, а ступінь дисоціації
зменшується, а ступінь дисоціації  зростає так, що значення
зростає так, що значення 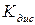 залишається сталим.
залишається сталим.
Слабкі електроліти, які під час дисоціації здатні утворити більш ніж два іони, дисоціюють ступінчасто. У розчинах таких речовин встановлюються складні рівноваги, в яких беруть участь іони різного складу:
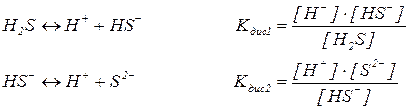
У разі ступінчастої дисоціації електролітів розщеплення за попереднім ступенем завжди відбувається значно більшою мірою, ніж наступними:

Сумарне рівняння дисоціації сульфідної кислоти:

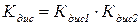
Дата добавления: 2015-09-02; просмотров: 890;
