Сильні електроліти.
До сильних електролітів відносяться:
ü сильні кислоти ( 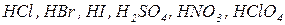 );
);
ü сильні основи ( 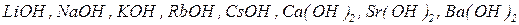 );
);
ü розчинні солі.
Сильні електроліти у розчинах дисоціюють необоротньо повністю:
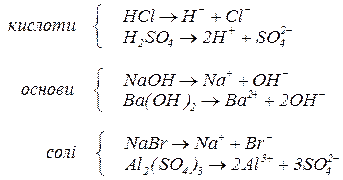
У дуже розбавлених розчинах позитивно та негативно заряджені іони настільки віддалені один від одного, що між ними електростатичне притягання практично відсутнє. У таких розчинах 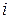 наближується до свого граничного значення. Зменшення взаємного притягання іонів в міру розбавлення розчину створює такий самий ефект, начебто в розчині зростає ступінь дисоціації електроліту.
наближується до свого граничного значення. Зменшення взаємного притягання іонів в міру розбавлення розчину створює такий самий ефект, начебто в розчині зростає ступінь дисоціації електроліту.
Зі збільшенням концентрації розчинів відстань між іонами зменшується, внаслідок чого зростають взаємне притягання різнойменно заряджених іонів та взаємне відштовхування однойменно заряджених іонів. Кожен іон виявляється оточеним іонами протилежного знака, так званою іонною атмосферою. Це призводить до рівномірного розподілу іонів по всьому об’єму розчину, подібно до їх розміщення в іонних кристалах, тільки на більшій відстані один від одного. Внаслідок такої електростатичної взаємодії рух кожного іона гальмується іонами протилежного знака. Це спричинює те, що ефективна концентрація іонів у розчині виявляється меншою від їх загальної концентрації, тому і експериментально отримане значення ізотонічного коефіцієнта також менше.
У розчинах з великою концентрацією сильних електролітів відбувається асоціація іонів за рахунок їх взаємного притягання та сольватації. Вона посилюється в міру зростання зарядів іонів і супроводжується утворенням іонних асоціатів катіонів з аніонами різного складу (іонних пар, трійок тощо) - 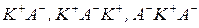 .
.
Для вираження ефективної концентрації іонів у розчинах електролітів було запроваджено поняття активної концентрації (активності іонів).
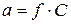
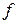 - коефіцієнт активності, який враховує електростатичну міжіонну взаємодію у розчинах і характеризує відхилення властивостей розчинів з концентрацією
- коефіцієнт активності, який враховує електростатичну міжіонну взаємодію у розчинах і характеризує відхилення властивостей розчинів з концентрацією 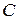 від властивостей нескінченно розбавлених розчинів.
від властивостей нескінченно розбавлених розчинів.
Коефіцієнт активності 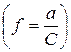 використовують для опису властивостей розчинів електролітів замість ступеня електролітичної дисоціації
використовують для опису властивостей розчинів електролітів замість ступеня електролітичної дисоціації 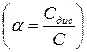 . Це зумовлено тим, що для сильних електролітів, які повністю дисоціюють на іони, поняття стпеня електролітичної дисоціації втрачає свій зміст, тому коефіцієнт активності
. Це зумовлено тим, що для сильних електролітів, які повністю дисоціюють на іони, поняття стпеня електролітичної дисоціації втрачає свій зміст, тому коефіцієнт активності 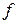 називають ще уявним ступенем дисоціації.
називають ще уявним ступенем дисоціації.
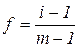
У сильно розбавлених розчинах електролітів їх протилежно заряджені іони не зазнають значного електростатичного притягання, тому в міру наближення до такого стану, коли 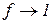 , значення активності іонів
, значення активності іонів 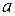 наближується до значення концентрації електроліту.
наближується до значення концентрації електроліту.
Дата добавления: 2015-09-02; просмотров: 808;
