Осмос. Осмотичний тиск.
Частинки розчиненої речовини і розчинника перебувають у безперервному русі і рівномірно розподіляються по всьому об’єму розчину. Якщо до розчину деякої речовини додати чистий розчинник і не перемішувати суміш, то завдяки хаотичному руху частинок розпочнуться процеси дифузії, і розчинена речовина розподілятиметься по всьому об’єму системи. При цьому частинки розчиненої речовини дифундуватимуть з розчину в розчинник, а частинки розчинника можуть вільно переміщуватись як з розчину в розчинник, так і з розчинника в розчин.
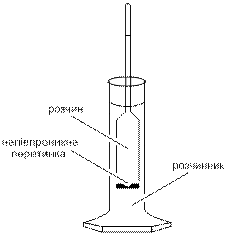
Якщо розчин (наприклад, цукру у воді) і розчинник (воду) розділити перетинкою, яка пропускає молекули води і не пропускає молекули цукру. То концентрація розчину вирівнюватиметься тільки внаслідок переміщення молекул води. Молекули води можуть рухатись із розчину в розчинник і в зворотному напрямку – з води в розчин. З більшою швидкістю відбувається дифузія в розчин, де концентрація води є меншою. Внаслідок цього об’єм розчину поступово зростає, а концентрація цукру в ньому зменшується.
Осмос – переважаюча дифузія молекул розчинника крізь напівпроникну перетинку в розчин.
Якщо розчин вмістити у посудину, яка вгорі переходить у вузьку вертикальну трубку, а знизу закрита напівпроникною перетинкою, то внаслідок осмосу об’єм розчину і в цьому разі збільшується, але з підняттям рівня рідини в трубці виникне надлишковий тиск (гідростатичний тиск). Зростання цього тиску є істотним. Надлишковий тиск розчину призводить до збільшення швидкості переміщення молекул води з розчину в розчинник, тобто протидіє осмосу. Коли гідростатичний тиск досягне певного значення, осмос припинеться, встановиться рівновага. Надлишковий тиск, який треба прикласти до розчину. щоб припинити осмос, називають осмотичним тиском.
Закон Вант - Гоффа:
осмотичний тиск розчину дорівнює тому тиску, який створила б розчинена речовина, якби вона перебувала в газоподібному стані і за тієї самої температури займала об’єм, що дорівнює об’єму розчину.
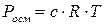
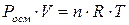
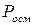 - осмотичний тиск розчину,
- осмотичний тиск розчину, 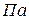 ;
;
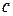 - молярна концентрація розчину,
- молярна концентрація розчину, 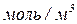 ;
;
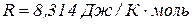 - універсальна газова стала;
- універсальна газова стала;
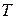 - абсолютна температура.
- абсолютна температура.
Хоча механізми газового (закон Менделєєва – Клапейрона: 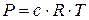 ) і осмотичного тиску істотно різняться, значення цих тисків чисельно дорівнюють одне одному, якщо число частинок розчиненої речовини і число молекул газу в одиниці об’єму однакове. Таким чином, осмотичний тиск, як і газовий тиск, визначається числом частинок і не залежить від їх природи.
) і осмотичного тиску істотно різняться, значення цих тисків чисельно дорівнюють одне одному, якщо число частинок розчиненої речовини і число молекул газу в одиниці об’єму однакове. Таким чином, осмотичний тиск, як і газовий тиск, визначається числом частинок і не залежить від їх природи.
Закон Вант – Гоффа справедливий тільки для розбавлених розчинів неелектролітів.
Дата добавления: 2015-09-02; просмотров: 1144;
