Концентрація розчинів.
Склад розчинів виражають через вміст розчиненої речовини. Якщо в розчині міститься кілька розчинених речовин, зазначають концентрацію кожної з них.
1. Масова частка  визначається відношенням маси розчиненої речовини
визначається відношенням маси розчиненої речовини  до загальної маси розчину
до загальної маси розчину 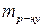 :
:

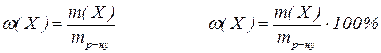
Для двокомпонентного розчину 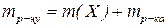 .
.

2. Молярна частка 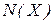 виражається відношенням кількості молів розчиненої речовини
виражається відношенням кількості молів розчиненої речовини  до загальної кількості молів усіх речовин у розчині
до загальної кількості молів усіх речовин у розчині  :
:


Для двокомпонентного розчину 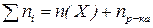 .
.

3. Моляльна концентрація, або моляльність 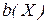 виражається відношенням кількості молів розчиненої речовини
виражається відношенням кількості молів розчиненої речовини  до маси розчинника
до маси розчинника  :
:
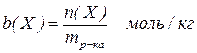
4. Молярна концентрація, або молярність  виражається відношенням кількості молів розчиненої речовини
виражається відношенням кількості молів розчиненої речовини  до об’єму розчину
до об’єму розчину  :
:

5. Молярна концентрація еквівалентів, або нормальність  виражається відношенням кількості молів еквівалентів розчиненої речовини
виражається відношенням кількості молів еквівалентів розчиненої речовини 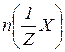 до об’єму розчину
до об’єму розчину  :
:
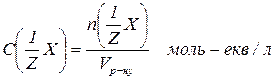

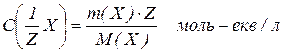
Процес розчинення є фізико-хімічним процесом. Це підтверджується тим, що розчинення супроводжується тепловими ефектами.
Уразі утворення істинних розчинів речовина, що розчинюється, подрібнюється до окремих молекул або іонів.
У разі розчинення полярної речовини у воді, треба затратити енергію на розірвання зв’язків між полярними молекулами. Ці зв’язки включають різні види міжмолекулярної взаємодії, серед яких найбільше значення мають водневі зв’язки.
У разі розчинення неполярної речовини у воді розривання зв’язку між його молекулами зводиться д подолання дисперсійної взаємодії, що зв’язує молекули неполярної речовини до розчинення.
Внаслідок розчинення розриваються зв’язки між частинками речовини, що розчиняється. Цей процес супроводжується затратою енергії  . Рушійною силою розчинення є інший процес - сольватація, у разі перебігу якого відбувається взаємодії між частинками речовини, що розчиняється, та молекулами розчинника. Сольватація включає різні види взаємодії, що залежать від природи частинок, що розчиняється, і властивостей молекул розчинника. В процесі сольватації виникають зв’язки між частинками речовини і молекулами розчинника, тому сольватація завжди супроводжується виділенням теплоти
. Рушійною силою розчинення є інший процес - сольватація, у разі перебігу якого відбувається взаємодії між частинками речовини, що розчиняється, та молекулами розчинника. Сольватація включає різні види взаємодії, що залежать від природи частинок, що розчиняється, і властивостей молекул розчинника. В процесі сольватації виникають зв’язки між частинками речовини і молекулами розчинника, тому сольватація завжди супроводжується виділенням теплоти 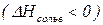 .
.
Загальний тепловий ефект розчинення  :
:

Розчинення найчастіше є оборотнім процесом. Якщо невелику порцію 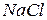 внести у воду, то вона досить швидко розчиниться. В міру зростання концентрації розчину швидкість розчинення зменшується і нарешті розчинення припиняється. Процес розчинення відбувається весь час, але проходить також і зворотній процес – виділення речовини з розчину. Чим більшою є концентрація розчиненої речовини, тим частіше її частинки, що містяться в розчині, стикаються з поверхнею речовини, що розчиняється, і повертаються у тверду фазу. Коли швидкості розчинення та кристалізації стають однаковими, розчин стає насиченим, розчинення далі не відбувається. Якщо концентрація розчину менша, ніж у насиченому, то швидкість розчинення перевищує швидкість кристалізації, і можливе подальше розчинення речовини. Такий розчин – насичений. Пересичений розчин – розчин, концентрація якого більша, ніж насиченого. Пересичені розчини – нестійкі системи.
внести у воду, то вона досить швидко розчиниться. В міру зростання концентрації розчину швидкість розчинення зменшується і нарешті розчинення припиняється. Процес розчинення відбувається весь час, але проходить також і зворотній процес – виділення речовини з розчину. Чим більшою є концентрація розчиненої речовини, тим частіше її частинки, що містяться в розчині, стикаються з поверхнею речовини, що розчиняється, і повертаються у тверду фазу. Коли швидкості розчинення та кристалізації стають однаковими, розчин стає насиченим, розчинення далі не відбувається. Якщо концентрація розчину менша, ніж у насиченому, то швидкість розчинення перевищує швидкість кристалізації, і можливе подальше розчинення речовини. Такий розчин – насичений. Пересичений розчин – розчин, концентрація якого більша, ніж насиченого. Пересичені розчини – нестійкі системи.
Дата добавления: 2015-09-02; просмотров: 640;
