Первый закон термодинамики. Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям
Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям. Он утверждает тот факт, что энергия не исчезает и не возникает вновь, но лишь переходит из одной формы в другую.
Рассмотрим рабочее тело массой М, которое характеризуется рядом параметров: давлением, объемом, температурой и т. д. При подведении к этому телу некоторого количества теплоты Q увеличивается кинетическая энергия движения микрочастиц, потенциальная энергия сил взаимодействия между ними, а также будет совершаться работа против действия внешних сил. Имеем частный случай закона сохранения энергии, который называется первым законом термодинамики.
Первый закон термодинамики: теплота, подводимая к системе, расходуется на изменение внутренней энергии тела и на совершение работы.
Математически первый закон термодинамики для элементарных изменений описывается следующим выражением:
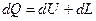 , (1.1)
, (1.1)
где dQ – подводимая к системе теплота, Дж;
dU – изменение внутренней энергии системы, Дж;
dL - работа системы против действия внешних сил, Дж.
Существует аналогичное выражение для удельных величин, отнесенных к единице массы:
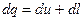 . (1.2)
. (1.2)
Выражение для термодинамического процесса:
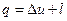 , (1.3)
, (1.3)
где q - подводимая в термодинамическом процессе удельная теплота, Дж/кг;
∆u - изменение в термодинамическом процессе удельной внутренней энергии системы, Дж/кг;
l - совершение системой в термодинамическом процессе удельной работы против действия внешних сил, Дж/кг.
Аналогично для выражения (1.1) для системы с массой М получаем, Дж:
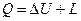 . (1.4)
. (1.4)
В выражениях (1.1) – (1.4), как алгебраических выражениях, каждый элемент может быть больше нуля, меньше нуля или равен нулю.
Существуют следующие частные случаи первого закона термодинамики:
1. Изобарный процесс. В данном процессе давление не изменяется 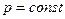 ,
,
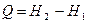 ,
, 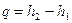 .
.
Теплота, подводимая в изобарном процессе, расходуется на изменение энтальпии.
2. Изохорный процесс. В данном процессе объем не изменяется 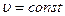 ,
,
 ,
, 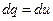 ,
, 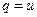 .
.
Теплота, подводимая к телу в изохорном процессе, расходуется на увеличение внутренней энергии тела.
3. Адиабатный процесс. В данном процессе теплообмен отсутствует
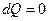 .
.
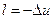 .
.
Работа расширения в адиабатном процессе производиться за счет внутренней энергии системы.
1. Изотермический процесс. Для идеального газа в этом процессе справедливо соотношение: 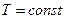 ,
, 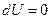 .
.
Следовательно:
 ,
,
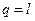 .
.
Теплота, подведения в изотермическом процессе, превращается во внешнюю работу.
Дата добавления: 2015-09-11; просмотров: 1720;
