Термодинамика процесса
Применение законов химической термодинамики дает возможность определить вероятность протекания реакции, максимальную степень превращения и равновесную концентрацию продуктов.
Термодинамическая вероятность протекания химической реакции определяется величиной изменения в процессе свободной энергии Гиббса ΔGT.
Зная величину, можно рассчитать константу равновесия реакции по уравнению:
lg KP = – ΔGT0 /4,575T.
Значение и знак при ΔGT являются критерием принципиальной осуществимости процесса, что вытекает из следующих рассуждений. Константа равновесия реакции определяется отношением:
KP = k1/ k2 ,
где k1 — константа скорости прямой реакции;
k2 — константа скорости обратной реакции.
Чтобы реакция протекала в прямом направлении (слева направо), скорость прямой реакции должна быть выше скорости обратной реакции, т. е. k1 > k2. В таком случае KP будет больше 1, a lg KP > 0.
Согласно уравнению, lg KP > 0 только при условии ΔGT0 < 0. Таким образом, необходимым условием протекания реакции в прямом направлении является отрицательное значение энергии Гиббса. Чем больше числовое отрицательное значение ΔGT0, тем выше скорость прямой реакции.
Изменение свободной энергии образования некоторых углеводородов в зависимости от температуры приведено на рисунке 11.
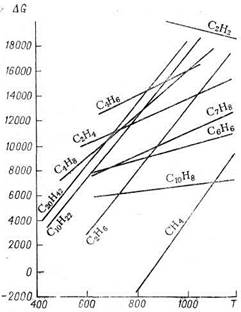
Рисунок 11 — Зависимость свободной энергии образования
углеводородов от температуры
Как следует из этого рисунка, термодинамическая стабильность всех углеводородов, за исключением ацетилена, понижается с повышением температуры. В одном гомологическом ряду стабильность падает с повышением молекулярной массы. При высокой температуре алкены, алкадиены и арены значительно более устойчивы, чем алканы и циклоалканы. Отсюда можно сделать вывод, что для переработки алканов в алкены достаточно простого нагревания до высокой температуры. Однако алкены при любой температуре неустойчивы к вторичным реакциям, например к полимеризации. Кроме того, даже при относительно низкой температуре термодинамически возможен распад углеводородов на элементы. Вследствие этого общее термодинамическое равновесие системы со временем сдвигается в сторону глубоких превращений (с образованием водорода, метана, смолы, кокса). При высокотемпературных процессах (например, пиролизе) время, следовательно, становится одним из основных параметров. Кинетические закономерности приобретают главенствующую роль над термодинамическими. Если конечной целью процесса является получение максимального выхода алкена, то реакцию надо остановить в момент наибольшей концентрации алкенов и не дать ей приблизиться к конечному термодинамическому равновесию.
Дата добавления: 2015-11-20; просмотров: 760;
