Современные представления о структуре белков.
Белки - сложные биополимеры, состоящие из аминокислот.
Все белки представляют собой полимеры, цепи которых собраны из фрагментов аминокислот. Аминокислоты – это органические соединения, содержащие в своем составе (в соответствии с названием) аминогруппу NH2 и органическую кислотную, т.е. карбоксильную, группу СООН. Из всего многообразия существующих аминокислот (теоретически количество возможных аминокислот неограниченно) в образовании белков участвуют только такие, у которых между аминогруппой и карбоксильной группой – всего один углеродный атом. В общем виде аминокислоты, участвующие в образовании белков, могут быть представлены формулой: H2N–CH(R)–COOH.
Общая химическая формула аминокислот (АК), являющихся структурным элементом белковой молекулы, может быть представлена следующим образом:


 R CH COOH
R CH COOH
NH2
В треугольнике выделена одинаковая для всех 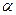 -аминокислот часть, а R-радикал или боковая цепь, специфична для каждой аминокислоты.
-аминокислот часть, а R-радикал или боковая цепь, специфична для каждой аминокислоты.
Группа R, присоединенная к атому углерода (тому, который находится между амино- и карбоксильной группой), определяет различие между аминокислотами, образующими белки. Эта группа может состоять только из атомов углерода и водорода, но чаще содержит помимо С и Н различные функциональные (способные к дальнейшим превращениям) группы, например, HO-, H2N- и др. Существует также вариант, когда R = Н.
В организмах живых существ содержится более 100 различных аминокислот, однако, в строительстве белков используются не все, а только 20, так называемых «фундаментальных».
Студентам следует повторить номенклатуру и основные свойства аминокислот из курса “Органическая химия”.
Свойства аминокислот разнообразны и они во многом определяют свойства белков.
По теории Э. Фишера аминокислоты присоединены друг к другу ковалентной амидной связью, которая возникает при взаимодействии α-карбоксильной группы одной аминокислоты с α-аминогруппой другой амино 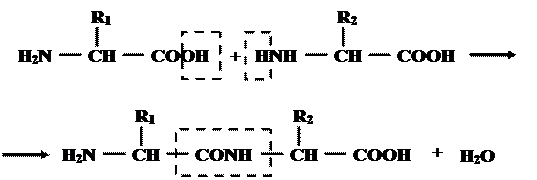 кислоты. При этом выделяется вода.
кислоты. При этом выделяется вода.
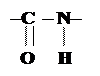 Продукты такой реакции называют пептидами, а сама связь между аминокислотами – пептидной.
Продукты такой реакции называют пептидами, а сама связь между аминокислотами – пептидной.
Пептидная связь является повторяющимся фрагментом полипептидной цепи, она имеет ряд особенностей, которые влияют не только на форму первичной структуры белка, но и на высшие формы организации его структуры.
У пептидов на одном конце – свободная аминогруппа, а на другом – карбоксильная. К этим группам могут присоединятся новые аминокислоты, благодаря чему происходит наращивание полипептидной цепи.
Свойства пептидной связи определяют во многом структуру и свойства самих белков. Знать свойства пептидной связи полезно для понимания причин многоуровневой организации белковой молекулы.
Свойства пептидной связи:
1. Пептидная связь копланарна - все атомы, входящие в состав пептидной единицы, находятся в одной плоскости.
2. Вращение вокруг связи C-N отсутствует.
3. C 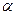 -атомы каждой пептидной связи находятся в транс-конформации.
-атомы каждой пептидной связи находятся в транс-конформации.
4. Пептидные группировки обеспечивают максимально возможное число водородных связей (каждая группа -СО-NH- способна образовать две водородные связи с соседними пептидными группами).Исключение пролин и оксипролин, которые образуют 1 водородную связь), что сказывается на формировании вторичной структуры белка, пептидная цепь на этом участке легко изгибается и молекуле образуются петли (шпильки).
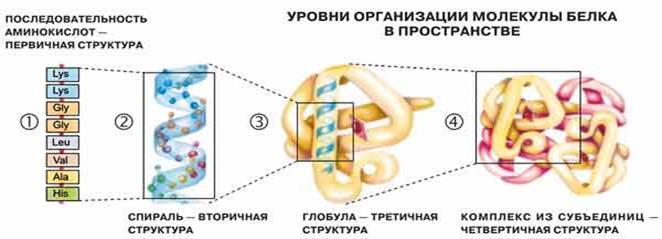
Структурная организация белковой молекулы имеет определенную иерархию структурных уровней, берущую начало от первичной структуры и заканчивающуюся четвертичной.
Первичная структураКаждый вид белка обладает строгой спецификой аминокислотного состава. уникальностью числа аминокислот и их последовательности в полипептидной цепи, что определяется понятием первичная структурабелка. Первичная структура белка предопределена генетическим кодом клетки. Она определяет пространственную структуру - конформацию белковой молекулы.
Вторичная структура- это специфическая упорядоченная ориентация полипептидной цепи в пространстве, обусловленная свободным вращением вокруг ее связей, соединяющих 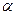 -углеродные атомы. (упорядоченное пространственное расположение отдельных участков полипептидной цепи) Если торсионные углы равны 45-60о , то вторичная структура белка представлена в виде
-углеродные атомы. (упорядоченное пространственное расположение отдельных участков полипептидной цепи) Если торсионные углы равны 45-60о , то вторичная структура белка представлена в виде 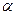 -спирали, если углы равны 120-135о, то образуется
-спирали, если углы равны 120-135о, то образуется 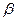 -структура.
-структура.
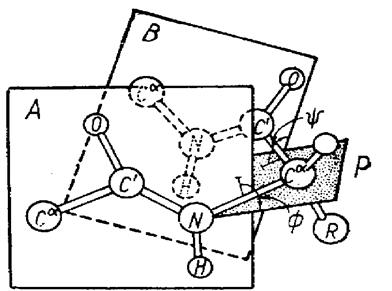 А и В - плоскости двух связанных пептидных единиц;
Р - плоскость, содержащая связи С
А и В - плоскости двух связанных пептидных единиц;
Р - плоскость, содержащая связи С 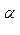 - N и С - N и С 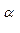 - С’, вокруг которых происходит вращение Ф и - С’, вокруг которых происходит вращение Ф и 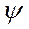 соответственно соответственно
|

ПРОСТРАНСТВЕННОЕ РАСПОЛОЖЕНИЕ ТОРСИОННЫХ УГЛОВ В ПОЛИПЕПТИДНОЙ ЦЕПИ
А и В - плоскости двух связанных пептидных единиц; Р - плоскость, содержащая связи С 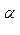 - N и С
- N и С 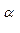 - С’, вокруг которых происходит вращение Ф и
- С’, вокруг которых происходит вращение Ф и 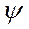 соответственно
соответственно
Отдельные витки спирали удерживаются многочисленными водородными связями с участием водорода аминогруппы и атома кислорода группы СО. При образовании спиралей радикалы, карбоксильные группы и аминогруппы остаются снаружи, что обуславливает возможность образования третичной структуры белка.

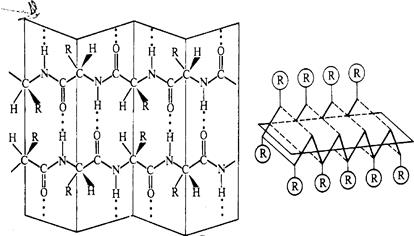

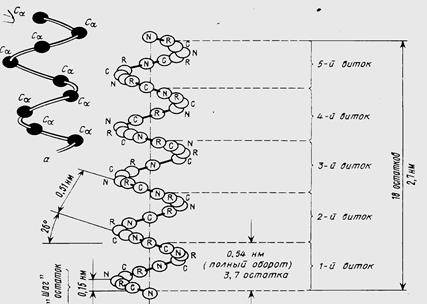
В пространстве аминокислотные остатки, составляющие белковую полипептидную цепь, плотно упакованы за счет примыкания друг к другу их боковых цепей за счет так называемого стэкинг-взаимодействия (англ. stack-стопка, кипа).
Третичная структура Полипептидная цепь складывается в пространстве в уникальную для каждого белка трехмерную конфигурацию, которая называется третичной структурой или конформацией белковой молекулы. Третичная структура определяет вид молекулы под микроскопом и поведение ее в различных средах.
Глобулярные белки по третичной структуре можно разделить на пять групп:
1. α-белки – белки с большим количеством спиральных структур
2. β-белки – белки, глобулы кот-х состоят из двух и более β-складчатых слоёв.
3. α / β-белки – представляют полипептидную цепь, состоящую из чередующихся α-спиралей и вытянутых β-участков цепи, сгруппированных в один β-слой.
4. (α + β) – белки, представляющие собой полипептидную цепь, разделенную на участки, целиком состоящие из спиралей, и на участки, имеющие форму β-складчатого слоя.
5. белки без α, β – это белки, в структуре которых практически нет спиральных и складчатых участков. Молекулярные глобулы состоят из ясно различимых долей – доменов.
Основные связи, стабилизирующие третичную структуру молекулы белка:
водородные связи между боковыми цепями аминокислотных остатков;
водородные связи между пептидными единицами;
ионные связи;
ван-дер-ваальсовы силы;
гидрофобные взаимодействия
Типы химических связей в белковой молекуле
В биомолекулах химические связи можно разделить на ковалентные и нековалентные. К ковалентным относятся пептидная и дисульфидная связи. Важную роль в поддержании пространственной структуры биологических молекул играют более слабые, чем ковалентные, химические связи (водородные и ионные связи, ван-дер-ваальсовы силы, гидрофобные взаимодействия).
Водородные связи. Этот тип появляется при электростатическом взаимодействии атома водорода с частично положительным зарядом и ковалентно связанного атома кислорода (азота) с отрицательным зарядом. Способность к образованию водородных связей ярко выражена у соединений, содержащих группы -СО, -NH, -ОН, -СОО-, -СОН.
В белковой молекуле водородная связь может образовываться между группировками пептидных цепей и боковыми цепями аминокислот. Водородные связи бывают внутримолекулярными и межмолекулярными. Единичная водородная связь довольно слабая и непрочная, однако образование даже нескольких таких связей, действующих кооперативно, представляет собой стабилизирующий фактор. Важное биологическое значение водородных связей определяется их участием в строении живой материи.
Гидрофобные взаимодействия. Соединения, несущие заряды, а также способные к образованию водородных связей, являются полярными, или гидрофильными. Вследствие того, что электроотрицательный заряд углерода близок к водороду, углерод не способен к образованию водородных связей. Связи С—Н непо-лярны, поэтому углеводородные цепи гидрофобны. Молекулы воды, стремясь образовать между собой водородные связи, выталкивают гидрофобные группы и молекулы, заставляя их преобразовываться в ассоциаты. Этот процесс идет самопроизвольно. Гидрофобные ассоциаты имеют первостепенное значение для «архитектуры» биомембран, нуклеиновых кислот и белков. В белках гидрофобные взаимодействия возникают вследствие стремления неполярных гидрофобных боковых цепей ряда аминокислот (Вал, Ала, Лей, Иле, Фен, Тир, Три) избегать контакта с водой. Полипептидная цепь при этом сворачивается как бы в клубок, внутри которого сближаются гидрофобные группировки, а на поверхности располагаются полярные группы, взаимодействующие с водой.
Ван-дер-ваальсовы силы.Силы межмолекулярного взаимодействия названы по имени голландского физика Я. Д. Ван-дер-Ваальса, впервые в 1873 году высказавшего предположение об их существовании. По своей природе эти связи напоминают водородные, так как возникают на основе кулоновских сил электростатического притяжения. Однако, если в образовании водородных связей участвуют постоянные диполи высокополярных ковалентных связей, то ван-дер-вааль-совы силы возникают при индуцированных, непостоянных диполях слабополярных ковалентных связей, например С-Н. Несмотря на то, что ван-дер-ваальсовы силы очень слабые, они фактически обусловливают ассоциацию многих неполярных группировок в биомолекулах.
Ионные связи. Данный тип основан на взаимном электростатическом притяжении противоположно заряженных ионов. Примером такого взаимодействия служит связь между отрицательно заряженной карбоксильной группой —СОО– и положительно заряженной протонированной аминогруппой –NH2+.
Важнейшей особенностью слабых химических связей является то, что их энергия незначительно превышает кинетическую энергию теплового движения (2,5 кДж/моль). Этого небольшого превышения оказывается достаточно, чтобы возникли слабые взаимодействия как внутри, так и между биомолекулами. Такие непрочные вторичные химические связи очень лабильны, что обусловливает их быстрое возникновение и распад.
Термодинамически выгодным оказывается расслоение системы, образование двух фаз - водной и углеводородной, что достигается сворачиванием глобулы и установлением гидрофобных контактов между неполярными радикалами. Сближение неполярных групп влечет за собой формирование ван-дер-ваальсовых контактов между ними. Но вклад этих весьма слабых взаимодействий в энергетику процесса свертывания белка невелик, тогда как роль гидрофобных контактов (роль изменения энтропии растворителя) при свертывании белка очень высока.
Форма белковой молекулы во многом определена третьим уровнем структуры, и особенно степенью асимметрии (отношением длинной части молекулы к короткой).
У фибриллярных (нитевидных) белков степень асимметрии более 80. К ним относятся кератин, коллаген и др. белки соединительных тканей. При степени асимметрии молекулы менее 80 белки образуют глобулу. Для многих глобулярных белков степень асимметрии равна 3-5. Следует отметить, что для белков с большой степенью асимметрии характерна  -структура, а для глобулярных белков более характерна
-структура, а для глобулярных белков более характерна  -спираль.
-спираль.
Главными структурными принципами глобулярной молекулы белка являются:
· компактная форма (за счет стэкинг-взаимодействия боковых групп);
· наличие гидрофобного ядра или ядер (за счет объединения неполярных аминокислотных остатков);
· наличие полярной оболочки (за счет ионных или полярных радикалов аминокислотных остатков).
При взаимодействии нескольких субъединиц происходит построение полиглобулярного белка с так называемой четвертичной структурой. Эта структура присуща ферментам и гемоглобину. Четвертичная структура стабилизируется всеми типами слабих связей и иногда ещё дисульфидными связями.
Каждая из перечисленных структур определяет свойства белковой молекулы в целом. Суммарные свойства неизменного белка получили название «нативные свойства», а их носитель, то есть неизменный белок – «наивный белок».
НАТИВНОСТЬ - это уникальный комплекс физических, физико-химических, химических и биологических свойств белковой молекулы, который принадлежит ей, когда молекула белка находится в естественном, природном (нативном) состоянии.
|
Свойства белков
Сложная структура белков предопределяет многообразие их свойств.
Дата добавления: 2015-11-18; просмотров: 5530;
