в пищевых технологиях.
Как явствует из самого названия, ферменты, входящие в класс оксидоредуктаз, катализируют окислительно-восстановительные реакции. Окисляемый субстрат рассматривается как донор водорода или электронов.
Оксидоредуктазы делятся на 17 подклассов.
  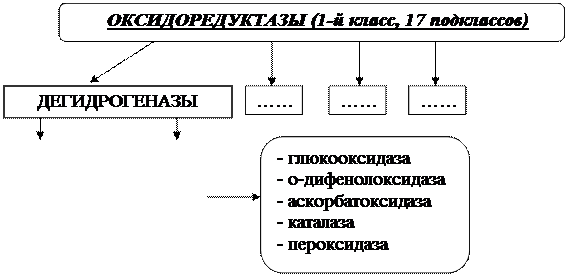 |
Ведущее место в классе рассматриваемых ферментов занимают дегидрогеназы, которые осуществляют реакцию дегидрирования:
АН2 + В = А + ВН2
По механизму переноса водорода на акцептор дегидрогеназы делятся на анаэробные и аэробные.
Аэробные дегидрогеназы способны передавать водород субстрата кислорода воздуха ( с образованием воды или перекиси водорода)
 АН2 + 1/2О2 АН2 + О2
АН2 + 1/2О2 АН2 + О2
или
 А + Н2О А + Н2О2
А + Н2О А + Н2О2
Среди представителей аэробных дегидрогеназ:
Глюкозооксидаза, переносящая Н2 от глюкозы на О2 с образованием Н2О2.
Этот фермент используют для удаления О2 из продуктов, окраска или аромат которых ухудшается в результате окислительных процессов (пиво, напитки, соки, жиросодержащие продукты). Для упаковки жиросодержащих продуктов испошльзуют синтетические пленки, пропитанные глюкозооксидазой, глюкозой и буфером. Удаление небольших количеств глюкозы желательно для предотвращения реакции меланоидинообразования при получении яичного и молочного порошка.
о-Дифенолоксидаза - (тривиальные названия тирозиназа, катехолаза, фенолаза, полифенолоксидаза), фермент катализирует окисление моно-, ди- и трифенолов.
При окислении монофенола фермент действует бифункционально:
Во-первых, происходит связывание О2 с ароматическим кольцом с образованием о-дифенола, а затем Н2 отнимается от дифенола и переносится на кислород с образованием воды.
Дифенолы окисляются без сопряжения с окислением монофенолов.
Темноокрашенные продукты (флобафены, меланины), возникающие как следствие действия фермента при чисто химической реакции конденсации двух образовавшихся хинонов.
Фермент находится в картофеле, фруктах, листьях растений.
В ряде случаев действие о-дифенолоксидазы приводит к появлению желательной окраски и аромата пищевых продуктов, например, при ферментации чая.
В то же время, большой интерес представляет замедление или предотвращение побурения растительных материалов, фруктов, овощей, соков. Для этих целей привлекают ингибиторы фермента. Применяют вещества, комплексирующие с о-хинонами, например, мета- и тетрабораты. Аскорбиновая кислота способствует восстановлению о-хинонов, но нужны ее высокие концентрации.
Чаще всего при переработке растительного материала для предотвращения побурения используют в качестве восстановителей сульфит натрия и двуокись серы.
В ряде случаев следует учитывать, что при рН ниже фермент инактивируется, а также то, что он термолабилен. Поэтому бланширование (тепловая обработка) позволяет исключить действие рассматриваемого фермента.
Аскорбатоксидаза катализирует окисление аскорбиновой кислоты.
Этот фермент найден во многих растениях, ответственен за разрушение витамина С. Имеются природные ингибиторы этого фермента: щавелевая, лимонная, винная кислоты, пектины, флавоноиды, некоторые белки.
Каталаза дегидрирует молекулу перекиси водорода:
Н2О2 + Н2О2 О2 + 2Н2О
Отнятый от субстрата водород переносится на вторую молекулу перекиси водорода.
Препараты каталазы из печени или микроорганизмов применяют при пастеризации и стерилизации молока.
Пероксидаза катализирует реакцию:
АН2 + Н2О2 А + 2Н2О
Для увеличения лежкости, сохранности пищевых продуктов важно ингибирование действия этого фермента.
При ферментации чая и табака пероксидаза наряду с фенолоксидазами способствует образовванию окрашенных и ароматических компонентов.
Липоксигеназа катализирует реакцию:
ненасыщенная жирная кислота + О2 = перекись ненасыщенной жирной кислоты
R - СН2 - СН = R1 + О2 R - СН = СН-R1
ООН
Фермент найден в пшенице, семенах масличных культур, бобовых, особенно велико его содержание в соевой муке.
Действие фермента необходимо ограничивать, т.к. его активность приводит к прогорканию жиров в продуктах, разрушению каротина.
Ингибитором этого фермента является токоферол.
В то же время окисление жиров пшеничной муки в процессе замеса теста приводит к укреплению клейковины.
Ферментные препараты
Ферменты находятся во всех клетках живых организмов. В течение десятилетий многие ученые мира работали с ферментами, изучая их свойства, кинетику действия на субстрат, обследуя микроорганизмы, растения, животные ткани на предмет обнаружения в них ферментов или же проявления их действия их действия. Были созданы основы для получения ферментных препаратов.
Ферментный препарат отличается от фермента тем, что помимо активного белка содержит различные балластные вещества. Часто такой препарат содержит не один, а несколько ферментов.
(На самостоятельное изучение)
Дата добавления: 2015-11-18; просмотров: 1282;
