Принцип работы свинцово – кислотной батарее
Работа аккумулятора основана на принципе, открытом еще в средние века: между двумя разными металлами, помещенными в кислый раствор, возникает электрическое напряжение. Если выводы металлов с помощью проводника соединить с потребителем, то по проводнику потечет электрический ток, внутри же аккумулятора начинается химическая реакция.
При погружении электрода выполненных из губчатого свинца (Pb) в раствор электролита (30%-ный раствор серной кислоты) ионы металла под действием электрохимической разности потенциалов переходят в раствор, заряжая его положительно, а электрод будет иметь избыток электронов и, следовательно, приобретает отрицательный заряд.
Раствор - это процентное отношение массы растворённого вещества к массе раствора. Например, 30% (масс.) водный раствор серной кислоты – это такой раствор в 100 единицах массы, которого содержится 30 единиц массы Н2SО4 и 70 единиц массы воды.
При погружении электрода в электролит выполненного из перекиси свинца (PbO2), катионы (положительно заряженный ион) из раствора активно осаждаются на поверхность электрода. Электрод в этом случае заряжается положительно. Между электродами образуется разность потенциалов величиной примерно 2В.
Элементарный свинцово-кислотный элемент представляет собой сосуд с электролитом. В этот раствор помещают 2 пластины. В заряженном аккумуляторе активная масса положительных электродов состоит из перекиси свинца РbО2 темно-коричневого цвета, а активная масса отрицательных электродов - из губчатого свинца серого цвета. Плотность электролита зависит от района эксплуатации батарей, она колеблется в пределах 1,22 - 1,30 г/см3 при 25°С.
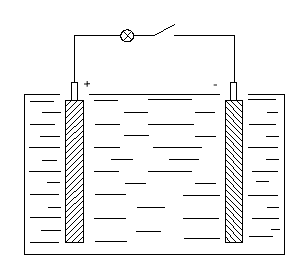
Рис. 8.2. Элементарный свинцово-кислотный элемент
При замыкании цепи, во внешней цепи ток идёт от положительной клеммы к отрицательной, то есть от «+» пластины к «-». При этом будет происходить химическая реакция с отдачей электроэнергии на питание нагрузки. Кислота начинает взаимодействовать со свинцовыми пластинами. Перекись свинца PbO2 положительной пластины и пористый свинец Pb отрицательной пластины превращаются в сернокислый свинец PbSO4 или сульфат свинца.
Электролит, в свою очередь, теряя кислоту, повышает содержание воды и удельный его вес (плотность) уменьшается. Эмпирически установлено, что зависимость напряжения элемента от плотности электролита определяется формулой,
E = 0, 84 + ρ,
где ρ – относительная плотность электролита, г/см³.
АК полностью разрядится, когда свинец Pb и перекись свинца PbO2 превратятся в сернокислый свинец PbSO4 или сульфат свинца, химический процесс прекратится. Процесс превращения химической энергии в электрическую можно назвать разрядом. Так как в процессе разряда серная кислота идет на образование сульфата свинца при одновременном выделении воды плотность электролита при 100%-ном разряде уменьшается примерно на 0,16 г/см3. Снижение плотности электролита на 0,01 г/см3 соответствует снижению емкости аккумулятора или увеличению степени разряженности примерно на 6%. По плотности электролита можно сделать заключение о степени разряженности аккумулятора.
Из практики известно, что нельзя допускать снижение напряжения свинцово-кислотного элемента ниже 1,8 В (10,8 В), так как электролит при этом имеет тенденцию превратиться в чистую воду, а на пластинах заметно вырастают кристаллы сульфата свинца, при образовании которых трудно перезарядить АБ.
Для того чтобы разряженный элемент привести вновь в рабочее состояние, его нужно зарядить, то есть аккумулятор включают в цепь параллельно источнику постоянного тока (генератору, выпрямителю), напряжение которого должно превышать ЭДС заряжаемого аккумулятора. Для этого к положительной пластине АКБ надо присоединить плюс источника тока, а к отрицательной – минус. И ток во внутренней цепи пойдёт от положительной пластины к отрицательной. Под действием тока при зарядке химические реакции пойдут в обратном направлении. Кислотный остаток SO4 сернокислого свинца обеих пластин и водород воды восстанавливают кислоту в электролите (H2 + SO4→H2SO4), происходит выделение кислоты и поглощение воды. А за счёт кислорода воды образуется перекись свинца на положительной пластине, а на отрицательной – чистый губчатый свинец, то есть состав пластин восстанавливается. Как только активная масса электродов преобразуется в двуокись свинца и губчатый свинец, плотность электролита перестает повышаться, что служит признаком конца заряда аккумулятора. Удельный вес электролита повышается, следовательно, напряжение на клеммах элемента будет расти, то есть процесс, при котором электроэнергия превращается, в химическую энергию, называется зарядом.
При дальнейшем заряде аккумулятора будет происходить только разложение воды на водород и кислород. Обильное газовыделение вызывает сильное «кипение» электролита. Такое явление нежелательно, так как кроме перерасхода электрической энергии оно вызывает снижение срока службы аккумулятора.
Дата добавления: 2015-08-14; просмотров: 1471;
