Электронное строение атома
В этом параграфе рассказывается о моделях электронной оболочки атома. Важно понимать, что речь идет именно о моделях. Реальные атомы, конечно, более сложны и мы пока знаем о них далеко не все. Однако современная теоретическая модель электронного стоения атома позволяет успешно объяснить и даже предсказать многие свойства химических элементов, поэтому широко используется в естественных науках.
Для начала рассмотрим более подробно "планетарную" модель, которую предложил Н. Бор (рис. 2.3).
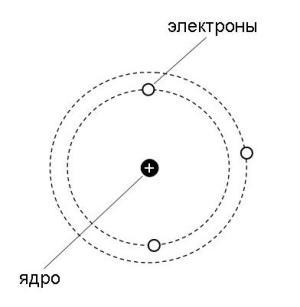
Рис. 2.3. "Планетарная" модель Бора.
Электронные орбиты в модели Бора обозначаются целыми числами 1, 2, 3, … n, начиная от ближайшей к ядру. В дальнейшем мы будем называть такие орбиты уровнями. Для описания электронного строения атома водорода достаточно одних только уровней. Но в более сложных атомах, как выяснилось, уровни состоят из близких по энергии подуровней. Например, 2-й уровень состоит из двух подуровней (2s и 2p). Третий уровень состоит из 3-х подуровней (3s, 3p и 3d), как показано на рис. 2.4. Четвертый уровень (он не поместился на рисунке) состоит из подуровней 4s, 4p, 4d, 4f.
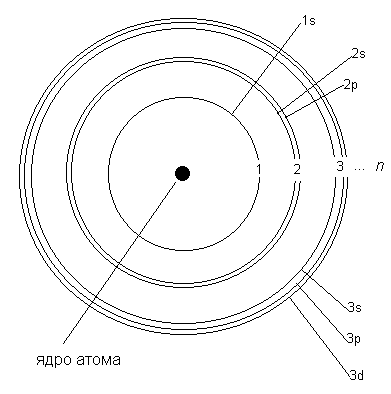
Рис. 2.4. Модель Бора для атомов более сложных, чем атом водорода. Рисунок сделан не в масштабе - на самом деле подуровни одного уровня находятся гораздо ближе друг к другу.
Во всех моделях атома электроны называют s-, p-, d- и f-электронами в зависимости от подуровня, на котором они находятся. Элементы, у которых внешние (то есть наиболее удаленные от ядра) электроны занимают только s-подуровень, принято называть s-элементами. Точно так же существуют p-элементы, d-элементы и f-элементы.
Атомные радиусы - числа, получаемые при измерении расстояний между центрами атомов в кристаллической структуре для соединений с ковалентной или металлической связью. В полиморфных модификациях величины атомных радиусов варьируют. Например, для углерода в алмазе, кубическая сингония, межатомные расстояния равны 1.54 A, для гексагонального углерода-графита -1.42 A. Соответственно, атомный радиус будет равен или 0.77, или 0.71 A.
Атомные радиусы элементов, у которых имеются s- и p-электроны, закономерно возрастают в каждой группе периодической системы в направлении сверху вниз, т. е. при увеличении числа электронных слоев в атоме. В пределах каждого периода слева направо, т. е. при возрастании числа электронов в слое, атомные радиусы уменьшаются. По мере заполнения всех внешних подгрупп электронов у атомов благородных газов радиус резко возрастает, поскольку в структуре этих элементов атомы соединены лишь остаточной (молекулярной) связью. Атомные радиусы элементов, содержащих d-электроны, в начале ряда уменьшаются, но затем, по мере увеличения количества электронов, начинают возрастать. У атомов, содержащих f-электроны, в пределах ряда наблюдается несколько отклонений от общей тенденции на фоне небольшого сокращения радиуса.
Ионные радиусы - это радиусы атомов, находящихся в состоянии ионной связи. Размер иона изменяется в зависимости от внешних условий и влияния соседних элементов, входящих в структуру минерала. Например, NH4+ и Cl образуют соединение, кристаллизующееся при температуре выше 184.3о в кубической структуре, где у каждого атома несколько соседей, а при более низкой температуре образуют минерал нашатырь кубической сингонии, имеющий восемь соседних элементов. В первом случае расстояние между
ионами 3.27 A, во втором - 3.35 A. Радиус иона зависит, прежде всего, от его валентности. При возрастании положительной валентности ионный радиус уменьшается по сравнению с атомным радиусом, а при отрицательной валентности - возрастает. Поэтому размер катионов в общем случае меньше, чем размер анионов.
В пределах периодической системы в каждом периоде слева направо радиус катионов при их валентности, отвечающей номеру группы, т. е. возрастающей от элемента к элементу на единицу, резко уменьшается из-за увеличения притяжения ядра. Радиус анионов меняется незначительно. У элементов, содержащих s-, p- и d-электроны, в первых периодах радиус ионов немного сокращается, далее - несколько возрастает. У элементов, образующихся за счет прибавления f-электронов, радиусы ионов постепенно уменьшаются во всем ряду. Для лантаноидов это явление получило название «лантаноидного сжатия», для актиноидов - «актиноидного сжатия». В вертикальных группах ионные радиусы возрастают сверху вниз, также как и атомные.
Сочетание перечисленных закономерностей создает еще одну тенденцию -близость величин ионных радиусов по направлению диагонали, проходящей слева сверху направо вниз в таблице Менделеева. Это направление предопределяет возможность изоморфных изменений.
Дата добавления: 2015-08-14; просмотров: 1443;
