Количественное сопоставление кислотных свойств оксигидроксидов. Эмпирические правила Полинга.
Пра́вила По́линга — два кристаллохимических закона о структуре кристаллов
1-ое Правило Полинга - расстояние катион - анион в координационном полиэдре определяется суммой ионных радиусов, а КЧ - их отношением.
2-ое Правило Полинга - сумма валентных усилий катионов первой координационной сферы, сходящихся на анионах, должна быть численно равна или почти равна валентности аниона:
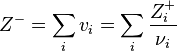
3-ье Правило Полинга - устойчивость структуры снижается при наличии общих ребер и особенно гранейкоординационных полиэдров.
4-ое Правило Полинга - высоковалентные и небольшие по размеру катионы стремятся не иметь общих анионов.
5-ое Правило Полинга - число разных по конструкции структурных фрагментов (координационных полиэдров) стремится к минимуму.
Координационный полиэдр - Воображаемый многогранник, вершинами которого являются ближайшие соседи одного сорта атомов к данному в кристаллической структуре. Обычно принято в качестве центра многогранника принимать положительно заряженный ион (катион), а в качестве вершин - отрицательно заряженные анион
Билет №5 1. Сера, селен, теллур, полоний (Э). Кристаллические модификации. Взаимодействие с кислородом, активными металлами и кислотами-окислителями. Сравнение кислотных свойств соединений Н2Э, Н2ЭО3 и Н2ЭО4.
В основном состоянии атомы халькогенов имеют электронную конфигурацию ns2np4. сера — типичный неметалл, селен и теллур — металлоиды с характерными металлическими свойствами, полоний — металл. В соединениях серы, селена, теллура с кислородом и галогенами реализуются степени окисления +6, +4, +2. С большинством других элементов они образуют халькогениды, где находятся в низшей степени окисления (-2). Устойчивость Э+6 понижается от серы к полонию, для которого стабильны соединения со степенью окисления +4, +2. Способность атомов элементов соединяться в кольца или цепи называется катенацией. Наиболее характерна катенация для серы, селена и теллура. Полоний — радиоактивный элемент. Ромбическая S(ромб.) и моноклинная S(мон.) модификации серы построены из циклических молекул S8, размещенных по узлам ромбической и моноклинной кристаллических решеток. В ромбической сере наименьший элементарный объем имеет форму прямоугольного параллелепипеда. В случае моноклинной серы в форме скошенного параллелепипеда. Молекула S8 имеет форму короны, ромбическая сера представляет собой легкоплавкий светло-желтый порошок. Он нерастворим в воде. Сера хорошо растворима в жидком аммиаке, а также в некоторых органических растворителях:. При комнатной температуре они неустойчивы: Если медленно нагревать ромбическую серу на воздухе, то она расплавится. При закалке, т. е. быстром охлаждении расплавленной серы, предварительно нагретой до температуры кипения, образуется метастабильная пластическая модификация, образованная спиральными цепями из атомов S с левой и правой винтовыми осями вращения. Со временем эта модификация постепенно переходит обратно в ромбическую серу. Полиморфизм селена и теллура связан с многообразием способов упаковки молекулярных цепей и циклов в кристаллах. Красные моноклинные модификации селена (α,β,y), образующиеся при кристаллизации растворов селена в сероуглероде, состоят из циклических гофрированных молекул Se8, похожих на S8, Аморфный красный селен осаждается из водных растворов его соединений действием S02 и других восстановителей. Наиболее термодинамически устойчива серая гексагональная модификация селена, обладающая металлическим блеском Она образуется при нагревании всех остальных модификаций. Серый селен состоит из неразветвленных спиральных полимерных цепей Sen, Для теллура существует только одна гексагональная модификация, аналогичная гексагональной модификации селена и также состоящая из бесконечных параллельных спиральных цепей. Металлический полоний существует в виде двух кристаллических модификаций: низкотемпературной кубической и высокотемпературной гексагональной . сера — типичные диэлектрики , селен и теллур — полупроводники, а полоний — металл. В водных растворах гидриды Н2Э ведут себя как слабые двухосновные кислоты. Cила кислот возрастает от серы к теллуру
Халькогеноводороды сгорают на воздухе с образованием диоксидов:
Н2Э +1/2О2 = ЭО2+Н2О
Сернистая кислота H2S03 в индивидуальном состоянии не выделена. Селенистая кислота H2Se03 — белое кристаллическое вещество, хорошо растворимое в воде. Ее получают окислением селена разбавленной HN03:
3Se + 4HN03 + Н20 = 3H2Se03 + 4NOt
Теллуристая кислота — это гидратированный диоксид Те02 • хН20*. Она образуется в виде белого осадка при гидролизе тетрагалогенидов:
ТеС14 + (2 + х)Н20 = Те02хН204 + 4HC1
Сила кислот уменьшается в ряду H2S 03—H2Se03—Н2Те03. Сера в сульфит-ионе может выступать в качестве восстановителя или окислителя. Сернистая кислота и ее соли обладают ярко выраженными восстановительными свойствами, окисляясь при этом до сульфата или дитионата:
Восстановительные свойства селенистой и теллуристой кислот выражены слабее. При взаимодействии с более сильными восстановителями сернистая кислота проявляет окислительные свойства:
2H2S03 + Zn = ZnS204 + 2Н20
окислительные свойства Н2Те03 выражены сильнее, чем сернистой кислоты. селенистая кислота окисляет S02 до H2S04, восстанавливаясь до свободного красного селена:
H2Se03 + 2S02 + H20 = Se4 + 2H2S04
H2Se03 + Н2О2 = H2Se04 + Н20
Серная кислота смешивается с водой в любых соотношениях. кислотные свойства H2S04 выражены сильно
HN03 + 2H2S04 = N02 + H30+ + 2HSO;
Безводная H2Se04 — бесцветное неустойчивое кристаллическое вещество
H2S04 и H2Se04 — сильные двухосновные кислоты . Н6Те06 При 160 °С она теряет воду, образуя полимерную мета-форму Н2Те04. В ряду S04-—Se04_—H5Te06~ наблюдается немонотонное изменение стабильности и окислительной способности: селеновая кислота и ее соли термодинамически оказываются менее стабильными и более сильными. окислителями, чем соответствующие кислоты и соли S(VI) и Te(VI). большей окислительной способности. селеновая кислота выделяет хлор из концентрированной НС1:
H2Se04 + 2HC1 = Cl2t + H2Se03 + H20
растворяет без нагревания медь и даже золото:
2Au + 6H2Se04 = Au2(Se04)3 + 3H2Se03 + 3H20
ортотеллуровая кислота по окислительной способности также превосходит серную, хотя и существенно уступает селеновой. Серная кислота обладает сильными окислительными свойствами только в концентрированном растворе и при нагревании:
2H2S04(kohu.) + Си = CuS04 + S02T + 2Н20
С серной кислотой реагируют многие простые вещества — металлы и неметаллы. На холоде H2S04 инертна по отношению как железо, алюминий и даже барий. Сера и селен не реагируют с водными растворами кислот, хотя растворяются в концентрированных серной и азотной кислотах:
Se + 4HN03(koh4.) = H2Se03 + 4N02t + Н20
Теллур также инертен к кислотам-неокислителям. Разбавленная азотная кислота окисляет его до теллуристой кислоты Н2Те03, концентрированная — до оксогидроксонитрата Te203(OH)N03. Полоний легко растворяется в кислотах с образованием солей полония(2)
2. Ванадий, ниобий, тантал. Сравнение свойств соединений Э5+ на основе диаграмм Фроста. Отношение V0 к HF и HNO3. Взаимодействие Nb и Ta со смесью HF+HNO3 и расплавами щелочей. Кислотно-основные свойства оксидов и гидратов оксидов Э5+.
V, Nb и Та — серые тугоплавкие металлы с объемно центрированной кубической решеткой.
элементы пятой группы имеют по пять валентных электронов.. V c.o: (-3), (-1), 0, (+2), +3, +4, +5; Nb: (-1), 0, (+2), (+3), +4, +5; Ta: (-1), 0, (+2), (+3), (+4), +5. при переходе от ванадия к ниобию радиус растет, а затем остается практически неизменным, что является следствием лантаноидного сжатия. ниобий и тантал имеют одинаковые атомные и ионные радиусы, близкие значения электроотрицательности, сходные химические свойства. V и особенно Nb и Та отличаются высокой химической стойкостью. Ванадий на холоду растворяется лишь в царской водке и концентрированной HF, а при нагревании — в HNO3 и концентрированной H2SO4. Ниобий и тантал растворяются в смеси фтороводородной и азотной кислот с образованием отвечающих их высшей степени окисления анионных фторокомплексов:
ЗТа + 5HNO3 + 21HF = 3H2[TaF7] + 5N0 + 10Н2О
Ванадий, ниобий и тантал взаимодействуют также при сплавлении со щелочами в присутствии окислителей, 4Э + 5О2 + 12КОН = 4К31э04] + 6Н2О
Для ванадия известны все степени окисления от -3 до +5. Из них в кислородных соединениях наиболее устойчива степень окисления +4 (в кислой среде) и +5 (в нейтральной и щелочной средах). Для ниобия и тантала наиболее устойчива степень окисления +5. Соединения V(V), Nb(V), Ta(V). В ряду V(V) - Nb (V) - Ta(V) устойчивость соединений возрастает.
Оксованадаты (V), оксониобаты (V) и оксотанталаты (V) — кристаллические вещества сложного состава и строения. В большинстве своем они — полимерные соединения.
Окислительные свойства соединений в высшей степени окисления ослабевают при переходе от ванадия к ниобию и танталу. Так, ванадий может быть восстановлен водородом в момент выделения до степени окисления +2, ниобий — до степени окисления +3, соединения тантала в реакцию практически не вступают.
ванадий — оказывается значительно более реакционноcпособным по сравнению со своими тяжелыми аналогами. В то же время он менее активен, чем титан, что, по-видимому, может быть связано с d3-конфигурацией, обладающей повышенной устойчивостью. Так, в отличие от титана ванадий не вступает в реакции с кислотами-неокислителями, за исключением плавиковой, с которой он взаимодействует благодаря образованию прочного фторидного комплекса:
2V+ 12HF = 2H3[VF6] + ЗН2Т
Диаграмма Фроста:
Дата добавления: 2015-08-11; просмотров: 1930;
