Химические свойства. Сухой и прокаленный остаток - характеризует общее солесодержание растворенных в воде веществ
Сухой и прокаленный остаток - характеризует общее солесодержание растворенных в воде веществ. Сухой остаток определяется путем выпаривания определенного объема предварительно профилированной через бумажный фильтр воды и последующего высушивания остатка при температуре 105 -120°С до постоянного веса.
Для более точного определения солесодержания получают прокаленный остаток, который определяют путем прокаливания сухого остатка при температуре 800°.
В воде источника, используемого для питьевых целей, сухой остаток не должен превышать 1000 мг/л и особых случаях 1500 мг/л (по согласованию с санэпидемстанцией).
Жесткость воды - обусловливается суммарной концентрацией в ней ионов кальция и магния, выраженной в эквивалентных единицах (мг-экв/л).
Жесткость бывает: общая, карбонатная, некарбонатная.
Карбонатная - часть общей жесткости, характеризующаяся содержанием в воде бикарбонатов и карбонатов кальция и магния.
Некарбонатная - часть общей жесткости, обусловленная содержанием в воде, главным образом сульфатов и хлоридов кальция и магния, и в меньшей мере - нитратов и силикатов кальция и магния.
Величина жесткости строго лимитируется в воде оборотных систем особенно для питания котлов, так как получаемые отложения кальция и магния снижают экономичность работы аппаратов, а иногда вызывают аварии.
Для питья жесткость воды практически не лимитируется, однако пользование водой повышенной жесткости в хозяйственных целях вызывает перерасход мыла, затрудняет варку овощей, мяса и т.д.
Поэтому по ГОСТ 2874-82 величина жесткости воды питьевого качества установлена не выше 7 мг-экв/л. В исключительных случаях 10 мг-экв/л = 2,8° (Н).
Щелочностьприродных вод, обуславливается присутствием в ней бикарбонатов и гуматов т.е. слабых солей органических кислот, выражается мг-эквы/л. Для природных вод, не содержащих заметных качеств натрия и кальция, щелочность воды равна ее карбонатной жесткости.
Активная реакция воды - характеризуется показателем концентрации в ней водородных ионов (рН).
При нейтральной реакции рН=7, при кислой < 7, при щелочной > 7.
Согласно СанПин 2.1.4.599-98, вода для хозяйственных и питьевых целей должна иметь рН в пределах 6,5-8,5.
Окисляемость воды. В связи с трудностью индивидуального аналитического определения многообразных органических веществ, содержащихся в природных водах, часто прибегают к суммарной их оценке определения окисляемости т.е. определяют количество окислителя (кислорода - О2 или Перманганата калия - КМпО4 в мг/л израсходованного для окисления органических (иногда на которых легко окисляющихся неорганических) веществ. Окисляемость чистых грунтовых вод обычно бывает равна 2-3 мг/л О2. В водах поверхностных источников окисляемость достигает 10-12 мг/л О2. Более высокая окисляемость указывает на загрязнение воды сточными водами.
Сульфаты и хлориды [SO 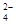 - и Сl-] - встречаются в воде в виде кальциевых, магниевых и натриевых солей (СаС12, MqCl2, Ca S04, NaC1). Повышенное содержание сульфатов и хлоридов обуславливает повышенный растворенный осадок, что препятствует использованию такой воды.
- и Сl-] - встречаются в воде в виде кальциевых, магниевых и натриевых солей (СаС12, MqCl2, Ca S04, NaC1). Повышенное содержание сульфатов и хлоридов обуславливает повышенный растворенный осадок, что препятствует использованию такой воды.
Допустимое содержание хлоридов (С1-) - 350 мг/л; сульфатов (S0 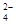 ) - 500 мг/л - для питьевой воды.
) - 500 мг/л - для питьевой воды.
Азотосодержащие вещества - (аммиак, азотистая и азотная кислоты) образуются в воде водоисточника обычно вследствие разложения белковых соединений, поступающих в источник в составе сточных вод, а также результате гниения отмерших растений.
Аммиак, попавший в воду, под действием присутствующих в ней бактерий последовательно превращается в азотистую и в азотную кислоту, поэтому вид содержащих в данное время азотосодержащих веществ позволяет судить о давности загрязнения воды.
При содержании только аммиака - говорит о недавнем загрязнении; содержание аммиака и нитратов свидетельствует о том, что со времени попадания в воду аммиака прошло уже некоторое время. Наличие нитратов и нитритов (соединений азотной кислоты) при отсутствии аммиака говорит о давнем загрязнении водоема.
Растворенные газы - при рассмотрении вопросов подготовки воды имеет значение в основном содержание в воде таких газов, как кислород - О2, сероводород - H2S и углекислота СО2. Растворимость газов зависит от температуры и давления.
О2 - кислород попадает в воду при соприкосновении ее с атмосферным воздухом. Кислород не ухудшает питьевых качеств воды, а усиливает коррозию металла.
Н2S - сероводород придает воде неприятный запах, вызывает коррозию металла, в связи с чем присутствие его в воде не допускается, как для хозяйственных целей, так и для большинства промпредприятий.
СО2 - углекислота в природных водах содержится в виде:
1. Свободной углекислоты, представляющей собой растворенный в воде газ СО2 и недиссоциированные молекулы Н2СОз (угольной кислоты).
2. полусвязной углекислоты т.е. в виде бикарбонатных ионов НСО 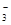 ;
;
3. связной углекислоты, т.е. в виде карбонатных ионов СО 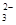 .
.
Соотношение между различными видами угольной кислоты зависит от величины рН.
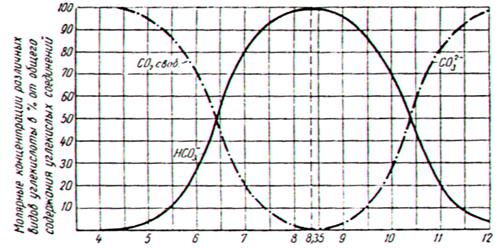
Наличие сводной углекислоты в воде вызывает коррозию бетонных сооружений и водопроводных сооружений.
Кроме указанных примесей нормируются другие растворенные химические вещества:
Железо (Fе2+3+) мг/л - не более 0,3
Марганец (Мn2+)____________ 0,1
Остаточный алюминий (Al3+)__ 0,5
Полиакриламид______________2,0
Свинец (Рв2+)________________0,1
Фтор (F-)__________________0,7-1,5 - Галоген
Серебро (Aq)________________0,05
Дата добавления: 2015-08-11; просмотров: 1766;
