Глобальная проблема – кровопотери и их последствия при катастрофах.
Травмы, кровопотери и, как следствие, – уменьшение объема циркулирующей крови наиболее характерны для различных катастроф. Борьба с последствиями кровопотерь является важнейшей задачей неотложной медицины, чему посвящено огромное количество теоретических и практических исследований и разработок. Тем не менее с точки зрения современной физиологии здесь имеется ряд нерешенных проблем.
Основные нарушения физиологических функций организма, связанные непосредственно с уменьшением объема циркулирующей крови, состоят в следующем: снижение артериального кровяного давления (АД), уменьшение венозного притока к сердцу, уменьшение минутного объема кровообращения (МОК), замедление обращения крови. Важнейшим следствием всех этих нарушений является кислородная недостаточность организма, и в первую очередь миокарда и мозга.
По данным Т. Дэвиса, потеря 10 % объема крови почти не отражается на АД, но ведет к уменьшению МОК на 20–25 %. При потере 20 % объема крови АД падает на 25–30 мм рт. ст., МОК – на 35–40 %, а потеря более 30–35 % объема крови приводит к резкому падению АД и к уменьшению МОК на 60–70 %. Оборот крови замедляется в2-3 раза.
Эти данные хорошо знакомы врачам, однако значительно менее известны физиологические механизмы компенсации снижения объема циркулирующей крови и эффективность соответствующих механизмов.
В настоящее время полагают, что основным регулятором объема крови является работа почек, которые повышают или понижают секрецию натрия. Выведение или задержка натрия в крови регулируется специальными гормонами. Один из них, открытый недавно и называемыйпредсердным натрийуретическим фактором (аtriаl natriuretic factor), образуется при увеличении объема крови, растяжении предсердий и включен в сложную систему гормональной регуляции функции почек.
Считается, что у человека после острой кровопотери соответствующие механизмы регуляции объема крови могут обеспечить поступление в кровяное русло до 1 л жидкости в час. Это, однако, теоретическая величина, а фактически при потере 25 % объема крови восстановление АД и объема крови происходит в течение 4–6 ч, а при потере 30–35 % объема крови восстановления за счет чисто физиологической компенсации может не произойти, и организм погибает.
Согласно биологическому закону симморфизма, генетически у гомойотермных животных и человека сформирован функциональный резерв каждой жизненно важной функции. Это означает следующее: по сравнению с относительным покоем кровообращение, дыхание, органы выделения и другие. могут повысить свою функциональную активность в 8-10 раз. Очевидно, физиологические механизмы, регулирующие постоянство объема крови, не подчиняются этому закону и настроены на сравнительно небольшие отклонения регулируемой величины, а при значительных и тем более массивных кровопотерях быстро достигают пределов компенсаторных (адаптивных) возможностей.
• Нарушение гемодинамики. Массивная кровопотеря специфически нарушает тонкие механизмы регуляции гемодинамики. Как известно, в системе венул (особенно в мозге) существует тенденция к реагрегации эритроцитов и к массовой адгезии лейкоцитов к стенкам венул, через которые они путем диапедеза проникают в ткани, где превращаются в плазматические клетки, выполняющие иммунные функции. Двум этим процессам способствует резкое физиологическое замедление скорости кровотока в венулах (по сравнению с артериолами аналогичного калибра) и резкое уменьшение кровяного давления. Оба этих фактора способствуют как реагрегации эритроцитов, так и массовой адгезии лейкоцитов. По данным К. П. Иванова (1993), в норме в физиологических условиях потоки эритроцитов из капилляров в венулы и из мельчайших венул в более крупные переходят не сливаясь, сохраняя свою динамическую структуру. Это препятствует реагрегации эритроцитов и смещению лейкоцитов к стенкам венул. Резкое замедление скорости обращения крови после массивной кровопотери приводит к деформации динамической структуры кровотока в венулах или к резкому ее нарушению. В результате в ряде микрососудов венозной системы происходит агрегация эритроцитов, массовая адгезия лейкоцитов, коагуляция крови, что приводит к закупорке сосудов и резкому ухудшению снабжения тканей кислородом. Такие явления составляют часть патогенетических механизмов геморрагического шока.
• Механизмы восстановления и адаптации при кровопотерях.
1. Механическое восполнение. Сравнительно малая эффективность физиологических механизмов восстановления массы потерянной крови затрудняет разработки мер по спасению человека при массивной кровопотере. Механическое восполнение потерянной крови сопряжено с определенным риском. Действительно, инфузия больших количеств донорской крови может усилить процесс микрокоагуляции крови в микрососудах и поэтому применяется редко. Инфузия больших количеств растворов кристаллоидов или коллоидных веществ нарушает физиологические отношения в гемодинамике и в обмене воды и ионов. Такие растворы приходится вводить в организм в объемах, в 1,5–1,6 раза превышающих величину потерянной крови, что вызывает, в частности, неадекватную нагрузку на сердце.
2. Физиологическая адаптация. При кровопотере уменьшение объема и кислородной емкости крови обычно происходит одновременно, однако физиологическая адаптация к этим нарушениям по механизмам и мощности существенно различается. Уменьшение объема циркулирующей крови на 30–35 % самостоятельно, физиологически, у человека не восстанавливается, о чем говорилось выше. При нормоволемии (нормальном объеме) кислородная емкость крови человека может уменьшиться в 3 и даже в 4 раза до 5–6% (об.) при сохранении сознания и основных физиологических функций. В этом отношении пределы физиологической адаптации у человека очень широки.
Механизм физиологической адаптации заключается, главным образом, в повышении скорости кровотока. При резком уменьшении кислородной емкости крови МОК у человека может увеличиться в 3–4 раза, что может обеспечить общий объем потребления кислорода, близкий к норме. При этом наиболее важно сохранить достаточную доставку кислорода в миокарде и в мозге. Действительно, в миокарде при снижении кислородной емкости крови скорость кровотока в микрососудах резко возрастает. Кроме того, миокард в состоянии относительного покоя получает кислород в определенном «избытке». Этот резерв может эффективно использоваться при уменьшении содержания гемоглобина в крови. В мозге измерить скорость кровотока в микрососудах при гемоделюции (разведении крови) по техническим причинам очень трудно, однако К. П. Иванову удалось сделать такие измерения с помощью кинотелевизионной техники. Было показано, что в венулах коры мозга диаметром 8-12 мкм при уменьшении гематокрита на 1/2 от 44 ± 1 до 22 ± 1 % скорость кровотока возросла от 2,0 ± 0,1 до 3,4 ± 0,1 мм/с, т. е. примерно в 1,5 раза. При снижении гематокрита до 17 % скорость кровотока в ряде венул увеличивается в 2–2,5 раза.
Определенную роль в улучшении снабжения тканей кислородом в данной ситуации может играть и сдвиг кривой диссоциации оксигемоглобина (КДО) вправо. Такой сдвиг в сочетании с ускорением обращения крови создает, однако, определенные физиологические проблемы для насыщения крови кислородом в легких.
Эффективность компенсаторных реакций организма при падении кислородной емкости зависит от ряда переменных, таких как фактическое содержание гемоглобина в крови, величина МОК, положение КДО крови, фактическая потребность в кислороде организма при данных конкретных условиях. Выяснение количественных отношений между этими параметрами представляет большой научный интерес с точки зрения анализа механизмов адаптации к снижению кислородной емкости крови, установления пределов их эффективности. Эмпирически указанные взаимоотношения проанализировать очень трудно из-за большой сложности и нелинейности взаимных влияний. Тем не менее для человека, который получил травму и потерял часть крови в результате несчастного случая или какой-либо катастрофы, необходима оценка эффективности механизмов физиологической адаптации с целью прогноза состояния и выбора мер по оказанию помощи.
Поэтому в настоящее время у больного срочно измеряют указанные выше параметры и определяют некоторые вспомогательные показатели, получая с помощью специальных программ на ЭВМ данные о состоянии и эффективности механизмов физиологической адаптации. Это новейший и весьма продуктивный метод изучения механизмов и пределов физиологической адаптации, который, несомненно, будет широко применяться.
Особая проблема адаптации к снижению кислородной емкости крови состоит в восстановлении числа эритроцитов и содержания гемоглобина. У человека этот процесс протекает очень медленно, однако разработка новых, наиболее активных стимуляторов гемопоэза позволяет значительно ускорить его. Следует отметить, что при массивных кровопотерях такая стимуляция оказывается недостаточно эффективной, возможно, из-за недостаточного количества так называемых стволовых клеток костного мозга, которые являются предшественниками всех форменных элементов крови. В среднем на 100 тыс. клеток костного мозга приходится только одна стволовая клетка. Недавно был разработан метод быстрого автоматического выделения стволовых клеток из костного мозга и выделен фактор SCF (facteur des cellules souches), стимулирующий дифференцировку стволовых клеток. Под воздействием этого фактора каждая стволовая клетка, введенная в организм, воспроизводит около 20 млн клеток крови за 24 ч. В принципе таким путем может быть решена проблема ускоренной адаптации к резкому снижению дыхательной емкости крови при массивных кровопотерях.
• Аноксия мозга и пределы адаптации к ней – наиболее важная проблема неотложной медицины при различных катастрофах и отдельных несчастных случаях, которая тесно связана с целым рядом фундаментальных проблем физиологии и биологии. С точки зрения физиологии сущность проблемы состоит в следующем. Во-первых, каков механизм сохранения мозгом жизнеспособности в течение некоторого времени после полного лишения его кислорода и энергии окисления. Во-вторых, каков первичный физиологический механизм изменений и прекращения функций мозга при аноксии и каковы физиологические механизмы восстановления этих функций.
К середине XX столетия в научной литературе распространилась точка зрения, согласно которой мозг человека сохраняет жизнеспособность – способность к восстановлению функций в течение 4–6 мин после остановки дыхания или 3–4 мин после остановки сердца. Определение указанных сроков имеет исключительно важное значение для неотложной медицины, поэтому в 1966 г. специальная комиссия, созданная при Национальной академии наук США, опубликовала рекомендации по методам реанимации человека при аноксии мозга. Врачам не рекомендовалось приступать к реанимации, если аноксия мозга длилась более 5–6 мин, так как по истечении этого срока восстановить физиологические функции мозга, как правило, не удается.
Мозг человека расходует в среднем примерно 1/5 часть энергетического бюджета организма в целом. Это составляет примерно 14,5 Вт или 14,5 Дж/с. Энергетические резервы тканей мозга составляют небольшую величину. В основном это глюкоза, которая содержится в количестве 0,45 мкмоль/г, т. е. около 0,00063 М для мозга массой 1400 г. При окислении этого количества глюкозы до СО2 и Н2О освободится примерно 1800 Дж, которые могут быть использованы для химической работы синтеза АТФ. Однако после прекращения доставки кислорода происходят только анаэробные превращения глюкозы. С точки зрения работы синтеза АТФ коэффициент полезного действия (КПД) анаэробиза уменьшается примерно в 15 раз. В таком случае легко рассчитать, что указанного количества глюкозы окажется достаточно всего на 8,2 с для работы нормальной интенсивности по синтезу АТФ из АДФ. Креатинфосфат содержится в мозге в количестве примерно 3,8 мкмоль/г. Согласно расчетам, это количество креатинфосфата теоретически способно обеспечить нормальную интенсивность синтеза АТФ из АДФ еще в течение примерно 30 с. Хорошо известно, что после внезапного перехода на дыхание чистым азотом человек теряет сознание через 10–15 с. Следовательно, энергетическая недостаточность прежде всего сказывается на функциональной активности мозга. Сохранение жизнеспособности требует, очевидно, значительно меньшей энергии. Заметим, что, по сделанным выше расчетам, энергетические резервы мозга могут быть израсходованы в течение 30–40 с. Однако следует помнить, что кровь еще обращается определенное время после остановки дыхания и глюкоза при этом в каком-то количестве будет утилизироваться из крови. Кроме того, надо учесть, что выключение функциональной активности при недостатке энергии (это условно можно отнести к явлениям адаптации) уменьшает потребности головного мозга в кислороде и энергии в 3–4 раза и более. Поэтому можно полагать, что в течение 3–4 мин после остановки дыхания мозг еще будет располагать некоторыми энергетическими резервами. Наступление необратимых изменений в мозге через 5–6 мин можно было бы объяснить полным исчерпанием энергетических ресурсов. С этой точки зрения установление предельных сроков сохранения жизнеспособности мозга при аноксии выглядит достаточно обоснованно.
Однако в 70-х годах были получены поразительные факты восстановления функций мозга у млекопитающих животных, вплоть до обезьян, после 30– и даже 45-60-минутной полной его ишемии. Оказалось, что длительная рециркуляция крови в мозге под повышенным давлением восстанавливает функции мозга животных после столь длительной ишемии. Эти факты позволяют сделать вывод, что мозг сохраняет жизнеспособность в течение довольно длительного времени при полном отсутствии притока энергии.
Возникает чрезвычайно важный для физиологии и неотложной медицины вопрос: в чем причина противоречий между старыми и новыми данными?
В 1968 году А. Амес с сотрудниками описали явление no-reflow, которое возникает после ишемии мозга и заключается в стазе крови в микрососудах мозга даже после кратковременной ишемии. Это препятствует восстановлению микроциркуляции при низком, постепенно повышающемся кровяном давлении в процессе реанимации.
Если после ишемии мозга стаз в крови в микрососудах преодолеть не удается, то мозг, длительное время сохраняя жизнеспособность, в конечном итоге гибнет в результате отсутствия кровообращения. Именно это и происходит при обычных методах реанимации. Если же микроциркуляцию удается возобновить, то функции мозга восстанавливаются даже через 30–60 мин полной ишемии, когда нервная ткань не получала кислорода и, возможно, энергию. Чрезвычайная важность этих данных для биологии, физиологии и неотложной медицины является бесспорной.
В чем причины no-reflow? Часто их объясняют повреждением стенки капилляров вследствие резкого замедления кровотока, периваскулярным отеком тканей в результате повреждения капилляров, сгущением крови в капиллярах и т. п. Однако, по данным К. П. Иванова, в физиологических условиях можно наблюдать капилляры мозга с чрезвычайно низкой скоростью кровотока вплоть до полной его остановки на некоторое время. Между тем при этом не отмечается явлений стаза или отека.
Как при геморрагическом шоке, о чем уже говорилось выше, так и при ишемии основной причиной остановки кровотока в капиллярах является, очевидно, массовая адгезия лейкоцитов к стенкам венул, реагрегация там эритроцитов и резкое сужение или закрытие просвета венул. Происходит это в результате нарушения динамической структуры кровотока в венулах, который предохраняет от этих явлений венозный кровоток в физиологических условиях. В последнее время были получены прямые экспериментальные подтверждения предположений этого автора.
Агрегация эритроцитов в венулах и адгезия лейкоцитов к их стенкам сами по себе не относятся к патологическим явлениям. В известной степени эти процессы происходят и в норме. Поэтому кровоток в венулах сравнительно быстро восстанавливается под влиянием повышенного кровяного давления.
Согласно экспериментальным данным К. П. Иванова (1997), восстановлению и поддержанию динамической структуры кровотока способствует гемоделюция примерно на треть, что препятствует агрегации эритроцитов и адгезии лейкоцитов в венулах. Гемоделюция вызывает также отчетливое увеличение скорости кровотока в микрососудах. Это подтверждает целесообразность клинических мероприятий в виде небольшой гемоделюции перед тяжелой операцией, что уменьшает вязкость крови и предупреждает гемокоагуляцию в микрососудах после кровопотери.
Адгезии лейкоцитов к стенкам венул в норме препятствует закись азота, которая выделяется эндотелием сосудов. Очевидно, было бы целесообразно найти методы применения этого вещества для улучшения микроциркуляции в мозге после ишемии.
• Причины, механизмы и пределы адаптации к недостатку кислорода. В митохондриях при окислении энергетических субстратов электроны последовательно восстанавливают ряд специфических переносчиков, отдавая на каждом этапе часть своей энергии, которая используется для синтеза АТФ. Цепи переносчиков в виде дыхательных ансамблей встроены во внутреннюю мембрану митохондрий. Последним звеном цепи оказывается кислород. Он принимает электроны и восстанавливается в химической реакции до воды. Если кислород, как генеральный акцептор, отсутствует, то все переносчики восстанавливаются, передача электронов в дыхательных ансамблях прекращается и синтез АТФ за счет энергии окисления приостанавливается.
Такой процесс наглядно демонстрируется с помощью рисунка гидравлической модели переноса электронов в дыхательных ансамблях, который обычно присутствует в учебниках по биохимии. Это, однако, весьма упрощенная схема. Она хорошо объясняет механизм нарушения клеточного дыхания при полном отсутствии О2, когда синтез АТФ за счет энергии окисления прекращается полностью. Однако, как правило, не обсуждается процесс изменений синтеза АТФ при постепенном снижении содержания кислорода в клетке до критической его величины и ниже.
Недавно Х. Фукуда с сотрудниками (1989) с помощью спектральной техники и парамагнитного ядерного резонанса показали, что в миоцитах миокарда при постепенном снижении рО2 самой чувствительной реакцией оказывается синтез АТФ. Он заметно снижается еще до начала продукции лактата и понижения величины рН. Так как практически все виды биологической работы в клетке совершаются за счет энергии гидролиза АТФ, логично было бы предположить, что уменьшается интенсивность всех рабочих процессов.
Однако ситуация оказывается значительно сложнее, поскольку энергетические требования к разным рабочим процессам разные. Это соображение и послужило основой новой концепции канадского физиолога П. Хочачка, которую он выдвинул в 1986 году: первичным звеном нарушений функций клетки при недостатке кислорода и энергии окисления является изменение концентрации ионов кальция в цитозоле. Эта концепция получила дальнейшее подтверждение, развитие и нашла свое применение в клинике нарушений мозгового кровообращения у человека.
Сущность концепции П. Хочачка. Как известно, концентрация ионов кальция в цитозоле очень мала и составляет 10-7-10-8 М. При такой малой концентрации в 1 мкм3 массы цитозоля содержится всего несколько ионов кальция. Однако именно при такой концентрации ионы кальция регулируют важнейшие биохимические и биофизические процессы в клетке. В физиологических условиях «избыток» ионов транспортируется через клеточную мембрану в околоклеточную среду, в митохондрии, в ретикулоэндотелиальную систему клетки. Низкая концентрация кальция в цитозоле поддерживается за счет некоторых других процессов, которые мы здесь не рассматриваем. Все эти процессы весьма энергоемки. Достаточно сказать, что перемещение одного иона кальция из цитозоля в околоклеточную среду, где концентрация ионов кальция почти в 10 тыс. раз больше, чем в цитозоле, требует гидролиза одной молекулы АТФ.
Вот почему при уменьшении синтеза АТФ первично нарушаются процессы, которые поддерживают низкую концентрацию кальция в клетке. Повышение концентрации ионов кальция не только тормозит зависимые от кальция реакции, но и вызывает их «дезорганизацию». Так, например, активизируются липазы, которые приводят к образованию активных радикалов, активизируются специфические фосфолипазы, которые начинают разрушать мембраны клетки и клеточных органелл.
Подробная схема развития этих процессов приводится в цитированных выше исследованиях, в упрощенном виде она представлена в монографии К. П. Иванова (1993). Таким образом, можно сказать, что пределы адаптации к недостатку кислорода и энергии окисления в значительной мере зависят от развития описанных выше явлений. Различные фармакологические препараты, облегчающие или стимулирующие кальциевый обмен, оказывают довольно существенное благоприятное воздействие на восстановление функций нервных клеток после ишемии. На процесс развития гипоксии, аноксии или ишемии эти препараты влияют лишь кратковременно, так как их действие направлено не на причину нарушений, а лишь на их последствия.
Острое охлаждение человека в результате различного рода несчастных случаев – эксидентальная гипотермия.Данный синдром возникает при транспортных катастрофах на воде, особенно ярко проявляется в морях северных и южных («высоких») широт. Эти случаи не так уж редки. По данным страховой компании Ллойда, в 70-х годах ежегодно терпели аварии и тонули в среднем 400 крупнотоннажных морских судов в год, а в настоящее время в связи с интенсификацией судоходства, увеличением числа кораблей и усложнением управления судами число катастроф резко возросло.
В связи с высокой теплопроводностью воды охлаждение тела человека при морских катастрофах может развиваться очень быстро, что является важной особенностью такого рода гипотермии. Охлаждение организма при различных обстоятельствах затрудняет и нарушает процессы адаптации к травмам, кровопотерям, голоду.
1. Физиологическая адаптация к острому охлаждению осуществляется прежде всего за счет уменьшения теплоотдачи тела в среду благодаря сужению кожных сосудов, что часто рассматривают как результат уменьшения теплопроводности периферических тканей. С точки зрения теплофизики теплопроводность тканей почти не меняется, поскольку она близка к теплопроводности воды.
Сужение кожных сосудов уменьшает тепломассоперенос кровью, т. е. передачу тепла из центральных областей тела во внутреннюю среду кровяной конвекцией. Эффективность этой реакции, особенно в холодной воде, невелика и не превышает одной единицы Кло (Сlо), международной единицы теплоизоляции, равной:
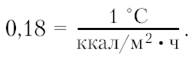
На воздухе это соответствует примерно защите от холода, которую дает одна плотная хлопчатобумажная рубашка. В воде такая величина малоэффективна.
2. Другая линия защиты – повышение теплопродукции за счет терморегуляционного тонуса и мышечной дрожи. Теплопродукция при этом повышается не более чем в 2,5–3 раза по сравнению с уровнем основного обмена. Столь низкая эффективность этих реакций объясняется тем, что мышцы не производят механической работы и источником тепла при терморегуляционном тонусе и дрожи является почти исключительно энергия активации, предшествующая сокращению мышечных волокон, что дает сравнительно мало тепла.
Мощным источником теплопродукции могла бы стать произвольная мышечная деятельность, которая повышает общую теплопродукцию организма в 10–15 раз. Однако приток крови к работающим мышцам резко увеличивает передачу тепла в среду. Поэтому использование интенсивной мышечной деятельности для предотвращения охлаждения тела в холодной воде весьма проблематично.
Человек, оказавшийся в воде при температуре 0 °C, выживает в течение 15–30 мин; при 5 °C – 15–60 мин; при 10 °C – 30–90 мин; при 15 °C – 2–7 ч; при 20 °C – 3-16 ч; при 25–26 °C – от 12 ч до нескольких суток.
Столь большие различия во времени выживания для разных людей при одной и той же температуре воды объясняются разными факторами, главный из которых – индивидуальные различия эффективности и пределов адаптации к холоду, равно как и неодинаковые температурные пороги потери сознания и выключения важнейших физиологических функций.
Закономерности теплообмена между телом человека и водой разной температуры до сих пор представляют собой сложную и нерешенную физическую и физиологическую проблему.
На воздухе спазм кожных сосудов снижает теплопотери едва на 8-13 %, в воде соответствующее снижение будет еще меньше. Пределы адаптации достигаются очень быстро. При погружении человека в воду, температура которой составляет 6 °C, температура кожи человека становится равной температуре воды всего через 10–12 мин. Тепломассоперенос кровью из центральных областей тела к коже практически прекращается, в то время как потеря тепла в результате кондукции резко возрастает в соответствии с увеличением температурного градиента между центром тела и средой.
Эффективность реакции повышения теплопродукции при защите от холода зависит от величины теплоизоляции. Обнаженный человек в воде с температурой 10–15 °C теряет в единицу времени в 10–15 раз больше тепла, чем на воздухе при такой же температуре. Для поддержания нормальной температуры тела в таких условиях ему необходимо повысить теплопродукцию соответственно в 10–15 раз. Определенный резерв тепла представляет химическая терморегуляция. Между тем ее максимальная мощность у человека невелика. Как уже упоминалось выше, она способна увеличить теплопродукцию по сравнению с уровнем основного обмена всего в 2,5–3 раза. Следовательно, химическая терморегуляция может лишь замедлить охлаждение тела, но не предотвратить гипотермию.
Таким образом, пределы адаптации к холоду за счет химической терморегуляции в воде достигаются очень быстро. Далее происходит неизбежное снижение температуры центральных областей тела. При этом при температуре тела в прямой кишке ниже 32 °C человек, как правило, теряет способность к самостоятельному разогреванию и восстановлению физиологических функций, хотя слабое легочное дыхание может сохраняться при температуре тела 24–26 °C, а слабые сокращения сердца с частотой 8-10 ударов в минуту иногда определяются и при температуре тела 20 °C. Такое сохранение жизнедеятельности при минимуме физиологических функций тоже можно квалифицировать как результат адаптации организма к низкой и сравнительно очень низкой температуре тела. Предел этого вида адаптации достигается при полном выключении основных жизнеобеспечивающих физиологических функций.
3. Механизм нарушения физиологических функций при постепенной гипотермии. Существует мнение, что главным первичным механизмом в этом случае является недостаток кислорода. Действительно, резкий сдвиг кривой диссоциации оксигемоглобина (КДО) влево, замедление кровотока и ослабление дыхания при гипотермии дают веские основания для таких предположений. Однако резкое уменьшение потребностей в кислороде при понижении температуры тканей и явления ацидоза в крови в принципе могут компенсировать ухудшение транспорта кислорода. Решение этой проблемы давно имеет принципиальное значение как для теории, так и для практики неотложной медицины.
Непосредственно у жертв морских катастроф определить состояние кислородного баланса в мозге и в миокарде вплоть до остановки спонтанного дыхания практически невозможно. Недавно исследователи попытались решить эту проблему на животных с помощью измерениярО2 в коре мозга крыс с помощью кислородного ультрамикроэлектрода с диаметром 3–5 мкм, включая изоляцию. Такие электроды практически не повреждают ткани и позволяют измерять рО2 в точечных участках между микрососудами. Из-за сложности методики такие электроды редко применяются в научных исследованиях. Е. П. Вовенко (1993) произвел соответствующие измерения с помощью кислородных ультрамикроэлектродов и установил, что при охлаждении в воде белых крыс величина рo2 в коре головного мозга остается на исходном или даже повышенном уровне вплоть до момента полной остановки дыхания, которая происходит при температуре мозга около 17 °C. Н. А. Слепчук (1995) показала, что у охлаждаемых крыс после полной остановки дыхания при температуре мозга около 17 °C нагревание специальным миниатюрным термодом продолговатого мозга на 2–3 °C приводит к восстановлению дыхательных движений, хотя тело еще продолжает охлаждаться.
Эти опыты имеют важное значение, так как показывают, что выключение важнейших центров мозга при охлаждении организма происходит не в результате гипоксии, а в результате прямого действия на нервную ткань низкой температуры. Можно предположить, что постепенное уменьшение частоты сокращений сердца при гипотермии имеет аналогичный механизм.
Такой вывод и такое предположение имеют важное значение в разработке методов неотложной медицины для спасения человека при глубокой гипотермии в результате несчастных случаев.
Дата добавления: 2015-08-11; просмотров: 1409;
