Общие химические свойства
Аминокислоты могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы -COOH, так и основные свойства, обусловленные аминогруппой -NH2, т.е они являются амфолитами.
NH3+– CRH – COO- + НС1 → [NH3+– CRH – COOН]С1
Соль катиона аминокислоты
NH3+– CRH – COO- + NаОН → NH2– CRH – COONа + Н2О
Соль аниона аминокислоты
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов.
Аминокислоты, которые могут находиться в трех формах: молекула, катион и анион, - называются нейтральными. Из 20 аминокислот 13 нейтральные: ала, асн, вал, гли, глн, иле, лей, мет, про, сер, тре, три, фен. Каждая из них в водных растворах по мере увеличения значения рН может находиться в сильнокислой среде в виде аниона, при рН = 7 – молекула, в щелочной среде – аниона
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO-. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот. Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Биполярно-ионная структура молекул аминокислот проявляется и в их физических свойствах: аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления, нелетучи, большинство их растворимы в воде и практически нерастворимы в неполярных органических растворителях.
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат ассиметричный атом углерода (треонин и изолейцин содержит два ассиметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму и лишь они входят в состав белка.
Оптические изомеры аминокислот претерпевают медленную самопроизвольную неферментативную рацемизацию. Например, в белке дентине (входит в состав зубов) L-аспартат переходит в D-форму со скоростью 0,1% в год, что может быть использовано для определения возраста биологических объектов.
Изоэлектрической точкой аминокислоты называют pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.

Комплексообразующие свойства. Все аминокислоты, отдавая протон, образуют хелатные комплексы с катионами d-металлов.
Например, при взаимодействии любой аминокислоты со свежеприготовленным Сu(ОН)2 образуется растворимый электронейтральный хелатный комплекс, окрашенный
в ярко синий цвет. Это биуретовая реакция, которой пользуется для обнаружения α-аминокислот (качественная реакция).
Электрофильно-нуклеофильные свойства.1) Реакция ацилирование – взаимодействие со спиртами:
NаОН
NH3+– CRH – COO- + СН3ОН + НС1 → Н2О + [NH3+– CRH – COOСН3]С1 →
→ NH2–CRH – COOСН3 + NаСl + Н2О
Метиловый эфир аминокислоты.
В организме аспарагиновая и глутаминовая кислоты под действием соответствующих ферментов и АТФ легко ацилируют аммиак с образованием аспарагина и глутамина соответственно:
аспарагинсинтетеза
NH3+– CH – COO- + NH3 NH3+– CH – COO- + Н2О
| АТФ |
СН2СООН СН2СОNH2
Аспарагиновая кислота аспарагин
При взаимодействии двух аминокислот со свободной аминогруппой и с активированной карбоксильной группой образуются дипептиды:
О Н
|| |
NH3+– CRH – COO- + NH2 –CRH – COOН → NH3+– CRH – C – N– CRH – COOН
2) Реакции алкилирования
СН3I СН3I
NH2 – CRH – COOН СН3NН – CRH – COOН
NаОН NаОН
СН3I
(СН3)2 N– CRH – COOН (СН3)3 N+ – CRH – COO-
NаОН Беатин аминокислоты
Окислительно-восстановительные свойства.Тиол-дисульфидное равновесие. Цистеин как все тиолы, выступая восстановителем, легко окисляется, образуя цистин, являющийся дисульфидом цистеина.
NH3+– CH – COO- -2е,- 2Н+ S – СН2 – СН(NH3+)COO-
2 | |
СН2 –SН +2е,+ 2Н+ S – СН2– СН(NH3+)COO-
Цистеин (восстановитель) Цистин (сопряженный окислитель)
При радиационном воздействии в водных средах организма возникают сильные окислители ·ОН, ·НО2, Н2О2 , ·О2, а также и другие токсиканты – короткоживущие сильные восстановители: гидратированный электрон, и атомарный водород. Сопряженный окислитель-восстановитель цистеин-цистин активно взаимодействует и с теми и с другими, нейтрализуя их.
При полном окислении цистеина образуется цистеиновая кислота, которая потом в результате реакции декарбоксилирования образует таурин. Таурин, взаимодействуя с холевой кислотой, образует таурохолевую кислоту, которая участвует в дальнейшем в эмульгировании жиров.
NH3+–CH – COO- [О] NH3+– CH – COO- (- СО2)
| | NH3+– СН2– СН2 –SН
СН2SО3- СН2 –SО3-
Цистеин цистеиновая кислота таурин
Декарбоксилирование.В лабораторных условиях протекает при участии Ва(ОН)2
+NH3– C0RH – C+3OO- + Ва(ОН)2 → NH2–C-1H2R + ВаС+4О3 + Н2О
Окис-ль Вос-ль
При декарбоксилировании α-аминокислот в организме синтезируются биогенные амины, выполняющие важные биологические функции:
Таблица 2 - Биогенные амины
| Исходная аминокислота | Биогенный амин | Формула амина |
| серин | 2-аминоэтанол (коламин) | NH2CH2CН2OН |
| цистеин | 2-аминоэтантиол | NH2CH2CН2SН |
| аспарагиновая кислота | β-аланин | NH3+CH2СН2– COO- |
| глутаминовая кислота | γ-аминомасляная кислота | NH2CH2CH2CН2COOН |
| гистидин | гистамин | NH2CH2СН2 NН |
| триптофан | триптамин | NH2 CH2СН2 N N |
Прямое дезаминирование. Этот процесс характерен для аминокислот у которых в β-положении содержится гидроксильная или тиольная группа.
Вос-ль СОО-
NH3+- C0H – COO- пиридоксальфосфат /
| С-2Н2 = С+1
С-1Н2 –SН - Н2S \
вос-ль ок-ль N+H3
Ок -ль Цистин енаминокислота
СОО-
/ Н2О
С-3Н3 – С+2 СН3 – С – СООН
\\ - NН3 ||
N+Н2 О
α-иминокислота пировиноградная кислота
Трансаминирование. Этот процесс в организме протекает при участии кофермента пиридоксальфосфата и соответствующей трансаминазы. Кофермент пиридоксальфосфат играет роль переносчика аминогруппы.
R - C0H – COO- + R' – C+2 – COOН пиридоксальфосфат
| || трансаминаза
Вос-ль NH3+ ок-ль О
R – C+2 – COOН + R' - C0H – COO-
|| |
О +NH3
Окислительное дезаминирование.а) Взаимодействие с азотистой кислотой. Используется для количественного определения аминных групп в аминокислоте., а также в белках и продуктах распада.
N+3H3– RCH – COO- + НN+3О2 НО – RCH – COOН + N20 + Н2О
Вос-ль Ок-ль
б) Частичное взаимодействие аргинина молекулой кислорода, в результате которого образуется цитруллин, один из продуктов цикла мочевины.
NH2– CH – COO-
| NО-синтетаза
2 (CH2)3NH – C – NH2 + НАДФ(Н) + 3О2 + Н+
||
NH2+
Н СОО-
\ /
С О + НАДФ+ + 2 NО + 2 Н2О
+ / \ ||
Н3N (СН2)3NН – С – NН2
цитруллин
Образующийся оксид азота (II) быстро используется в иммунной системе для устранения ксенобиотиков, а также для регуляции кровяного давления за счет расслабления мышц кровеносных сосудов.
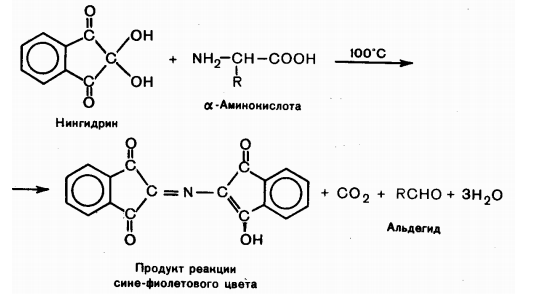
Взаимодействие с нингидрином. Общая качественная реакция α-аминокислот заключается во взаимодействии с нингидрином в водных растворах при нагревании и появлением сине-фиолетовой окраски, интенсивность которой зависит от концентрации α-аминокислот.
Взаимодействие с дегидрогеназой. В организме аланин, аспарагиновая и глутаминовая кислота подвергаются окислительному дезаминированию под действием соответствующих дегидрогеназ с коферментом НАД+ или НАДФ+.
1 стадия.
NH3+–C0H – COO-
| + НАД+ дегидрогеназа NH2+ = C+2 – COO-+ НАД(Н) + Н+
в-ль СН2 –СН2 – СОО- |
Ок-ль СН2 –СН2 – СОО-
Глутамат α- иминоглутарат
2 стадия
NH2+ = C – COO-
| + Н2О -ООССН2СН2 – С – СОО- + NH4+
СН2 –СН2 – СОО- ||
α- иминоглутарат О 2-оксалоглутарат
2-оксалоглутарат является одним из субстратов цикла Кребса.
Дата добавления: 2015-08-11; просмотров: 1389;
