Эффект Джоуля-Томсона. Изменение температуры газа при необратимом адиабатном расширении происходит из-за отклонения реальных газов от идеальности и называется эффектом
Изменение температуры газа при необратимом адиабатном расширении происходит из-за отклонения реальных газов от идеальности и называется эффектом Джоуля-Томсона.
Рассмотрим теплоизолированную систему, состоящую из двух поршней, заключенных в трубу, между которыми находится газ. Пусть поршни медленно движутся в одном направлении с постоянными скоростями внутри трубы. При этом газ будет просачиваться через пористую 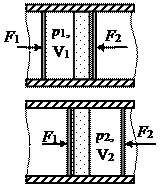 перегородку. Силы, действующие на поршни - постоянные. Пусть движение газа через пористую перегородку будет настолько медленным, что потерями на трение можно будет пренебречь. Но при этом процесс просачивания газа является необратимым. Так как процесс адиабатный, то
перегородку. Силы, действующие на поршни - постоянные. Пусть движение газа через пористую перегородку будет настолько медленным, что потерями на трение можно будет пренебречь. Но при этом процесс просачивания газа является необратимым. Так как процесс адиабатный, то 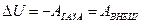 . Работа внешних сил :
. Работа внешних сил :
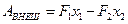 ,
,
где x1 и x2 – перемещение каждого из поршней. Если S1 и S2 – площади сечения трубы слева и справа, то
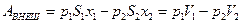 ,
,
где V1 и V2 – объёмы, а p1 и p2 - давления газа до и после просачивания.
В итоге:
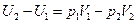 ,
,
откуда
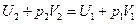
или
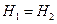 ,
,
т.е. процесс протекает с сохранением энтальпии.
При просачивании газа наряду с падением давления газа происходит изменение температуры. При небольшом перепаде давления 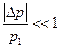 это явление называется дифференциальным эффектом Джоуля-Томсона,а при большом перепаде – интегральным эффектом.
это явление называется дифференциальным эффектом Джоуля-Томсона,а при большом перепаде – интегральным эффектом.
При дифференциальном эффекте коэффициент Джоуля-Томсона определяется как 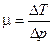 . Т.к. при этом
. Т.к. при этом 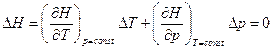 , то
, то 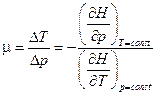 .
.
Но с другой стороны 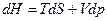 , поэтому
, поэтому 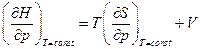 .
.
Так как при p = const 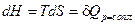 , т.е. изменение энтальпии равно подведенному количеству теплоты при изобарном процессе, то
, т.е. изменение энтальпии равно подведенному количеству теплоты при изобарном процессе, то 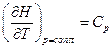 . Следовательно,
. Следовательно,
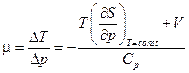 .
.
Так как 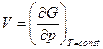 и
и 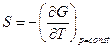 , то
, то 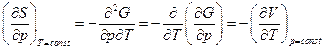 .
.
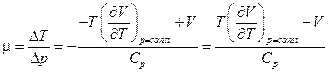 .
.
Для идеального газа 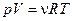 ,
, 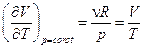 ,
, 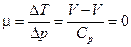 , т.е. при необратимом процессе расширения идеального газа температура не меняется.
, т.е. при необратимом процессе расширения идеального газа температура не меняется.
Для газа Ван-дер-Ваальса
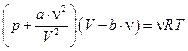 .
.
Раскрываем это уравнение 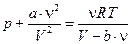 ,
, 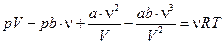 .
.
Находим производную по Т при p = const:
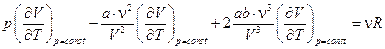 ,
,
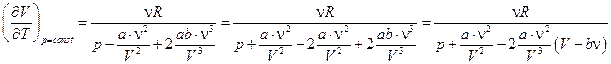 .
.
Учтем, что 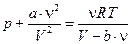 , тогда
, тогда
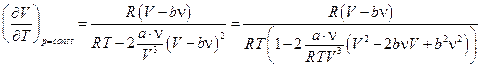 .
.
Если объём газа не очень мал (газ не плотный), то b<<V и можно пренебречь малыми величинами, тогда
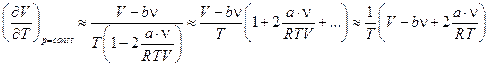
и для химического потенциала получаем:
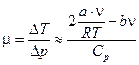 .
.
Отсюда следует, что изменение температуры вызвано отличием газа от идеального.
Из этого выражения следует, что существует некоторая температура 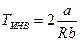 при которой m=0. Она называется температурой инверсии. Если T > TИНВ, то
при которой m=0. Она называется температурой инверсии. Если T > TИНВ, то 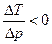 , т.е. DT > 0 при Dp < 0 - газ нагревается, а если T < TИНВ, то
, т.е. DT > 0 при Dp < 0 - газ нагревается, а если T < TИНВ, то 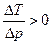 , т.е. DT < 0 при Dp < 0 - газ охлаждается. Нагревание газа называется отрицательным эффектом Джоуля-Томсона, а охлаждение - положительным.
, т.е. DT < 0 при Dp < 0 - газ охлаждается. Нагревание газа называется отрицательным эффектом Джоуля-Томсона, а охлаждение - положительным.
| Газ | a | b | ТИНВ, K | TКР, К |
| He | 0,00346 | 0,0000237 | 35,11 | 5,20 |
| Ne | 0,02135 | 0,00001709 | 300,67 | 44,54 |
| H2 | 0,02476 | 0,00002661 | 223,94 | 33,18 |
| Ar | 0,1363 | 0,00003219 | 1019,07 | 150,97 |
| N2 | 0,1408 | 0,00003913 | 866,01 | 128,30 |
| O2 | 0,1378 | 0,00003183 | 1041,94 | 154,36 |
| H2O | 0,5536 | 0,00003049 | 4369,86 | 647,39 |
Отметим, что температура инверсии больше критическойтемпературы газа Ван-дер-Ваальса.
Замечание. Расчет без введения предположений о величине объёма приводит к выводу о наличии двухтемператур инверсии.
Дата добавления: 2015-08-08; просмотров: 950;
