Теория электролитической диссоциации
Законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов. Обобщая экспериментальные данные, Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания, осмотическое давление для них всегда больше, чем вычисленные. Для учета этих отклонений Вант-Гофф внес в уравнение (III.16) для растворов электролитов поправку – изотонический коэффициент i:
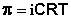 (III.18)
(III.18)
Аналогичная поправка вносится в законы Рауля и изотонический коэффициент определяется следующим образом:
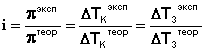 (III.19)
(III.19)
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Для объяснения особенностей свойств растворов электролитов С.Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:
1. Электролиты в растворах распадаются на ионы – диссоциируют;
2. Диссоциация является обратимым равновесным процессом;
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул N:
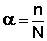 (III.20)
(III.20)
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0.7), средней силы (0.3 < α < 0.7) и слабые (α ≤ 0.3). К сильным электролитам относятся почти все соли (кроме Рb(СН3СОО)2, НgСl2, СdСl2), большинство неорганических кислот и щелочей; к слабым – все органические кислоты, вода, NН4ОН, Н2S и т.д. Электролитами средней силы являются некоторые неорганические кислоты: НF, НСN, Н3PO4.
Дата добавления: 2015-08-08; просмотров: 664;
