Электрохимические теории сродства
Создание Дальтоном атомной теории вновь поставило "проклятый вопрос атомизма" – вопрос о способе соединения атомов. Алессандро Вольта в 1800 г. представил доказательство несомненной связи между химическими реакциями и электричеством в виде первой электрической батареи ("Вольтов столб"). Последовавшие за этим блестящие успехи применения электричества в химии (разложение воды, выделение щелочных и щелочноземельных металлов) способствовали всеобщему убеждению естествоиспытателей в том, что силы, соединяющие атомы, должны иметь электрическую природу.
Первую электрохимическую теорию химического сродства предложил в 1807 г. английский учёный Гэмфри Дэви. Основные идеи теории состояли в следующем:
1. Атомы, способные соединяться химически, приобретают при контакте противоположные заряды;
2. Акт химической реакции представляет собой соединение атомов за счёт сил электростатического притяжения, при котором происходит компенсация зарядов;
3. Химическое сродство атомов пропорционально их полярности (величине возникающего заряда).
4. Если подействовать на соединение электричеством, атомы восстанавливают полярность и движутся к электродам.
Развивая представления Дэви, Й. Я. Берцелиус разработал в 1811-1818 гг. собственную электрохимическую теорию сродства. На основании изучения продуктов разложения солей, кислот и оснований, выделяющихся на электродах, Берцелиус создал весьма простую и наглядную дуалистическую систему:
1. Все атомы (простые и сложные) электрически заряжены и биполярны; при этом один из зарядов преобладает;
2. Соединение атомов сопровождается частичной нейтрализацией их зарядов;
3. При пропускании электрического тока атомы восстанавливают начальную полярность;
4. Химическое сродство пропорционально полярности веществ и температуре.
Все элементы Берцелиус расположил в ряд по знаку и величине присущего их атомам заряда. В начале электрохимического ряда располагался абсолютно электроотрицательный кислород, далее – электроотрицательные элементы (неметаллы) и переходный (индифферентный) элемент водород (оксид которого – ни кислота, ни основание). За водородом следовали переменные (одни оксиды которых – кислоты, другие – основания) и электроположительные элементы (щелочные и щелочноземельные металлы).
Кроме электрохимического ряда элементов, имелся и электрохимический ряд сложных атомов оксидов, в котором кислоты (кислотные оксиды по современной классификации) являлись электроотрицательными, а основания – электроположительными.
Все химические реакции сводились, таким образом, к взаимодействию зарядов. Берцелиус писал: "Сернокислый натрий составлен не из серы, кислорода и натрия, а из серной кислоты и натра, которые, в свою очередь, могут быть разделены на электроположительную и электротрицательную части". Учитывая, что под термином "серная кислота" Берцелиус, в соответствие с теорией кислот Лавуазье, подразумевает оксид серы SO3, образование сульфата натрия можно описать следующей схемой:
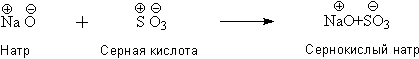
Для объяснения образования гидратных соединений Берцелиус предполагал, что вода может быть либо электроположительной, либо электроотрицательной частью соединения:

Несмотря на присущие недостатки, дуалистическая теория Берцелиуса (кстати, очень хорошо согласующаяся с представлениями Лавуазье о природе солей, кислот и оснований) весьма удачно объясняла многие реакции между неорганическими веществами. Положение о том, что молекула химического соединения построена из радикалов, способных к самостоятельному существованию, оказало существенное влияние на развитие теорий структурной химии. Отголоски электрохимических представлений Берцелиуса нетрудно найти в современной теоретической неорганической химии (электроотрицательность, поляризуемость и поляризующее действие ионов и т.п.). В XIX веке система Берцелиуса несколько десятилетий представляла собой одну из теоретических основ химии.
Дата добавления: 2015-08-08; просмотров: 1090;
