Стадия 3. Обрыв цепи
Последовательно идущие реакции роста цепи могут прерваться, если произойдет исчезновение свободного радикала. Чаще всего обрыв цепи происходит за счет взаимодействия радикалов хлора между собой.
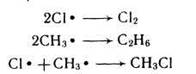
У высших алканов свободный атом галогена атакует, прежде всего, атом водорода у 3-ого атома углерода, затем у 2-ого и в последнюю очередь у первичного, т. е. проявляется избирательность в атаке галогена. Это объясняется тем, что легче всего гомолитически разрывается связь третичного атома углерода с водородом — энергия связи 376 кДж/моль; затем вторичного — 390 кДж/моль и, наконец, первичного — 415 кДж/моль. Поэтому и устойчивость образующихся при этом радикалов будет увеличиваться в ряду:

Чем стабильнее свободный радикал, тем легче и быстрее он образуется.

 Реакции электрофилъного замещения (SE). Для ароматическихсоединений бензольного ряда, конденсированных и гетероциклических ароматических соединений характерны реакции SE –типа. Особенностью реакций SE является то, что атакующий реагент — электрофил — образуется на первой стадии реакции в присутствии кислот Льюиса – AICI3, FeBr3 (реакции галогенирования, алкилирования по Фриделю -Крафтсу.) либо в условиях кислотного катализа (алкилирование алкенами и спиртами, нитрование), например:
Реакции электрофилъного замещения (SE). Для ароматическихсоединений бензольного ряда, конденсированных и гетероциклических ароматических соединений характерны реакции SE –типа. Особенностью реакций SE является то, что атакующий реагент — электрофил — образуется на первой стадии реакции в присутствии кислот Льюиса – AICI3, FeBr3 (реакции галогенирования, алкилирования по Фриделю -Крафтсу.) либо в условиях кислотного катализа (алкилирование алкенами и спиртами, нитрование), например:
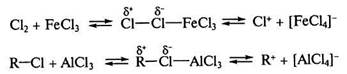
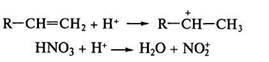
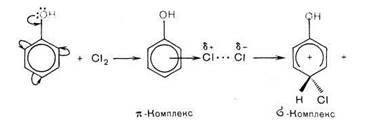
Образовавшаяся электрофильная частица Е+ атакует нуклеофильный центр — бензольное ядро. В результате атаки образуется неустойчивая структура (σ-комплекс) с нарушенной системой кругового сопряжения. Эта стадия является лимитирующей (стадия I). Стабилизация структуры происходит путем отщепления протона от σ -комплекса с образованием конечного продукта. В общем процесс (Е+ = Cl+, Br+, R+, NO2+ и др.) протекает по схеме:
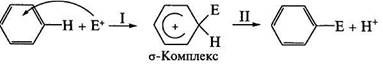
На реакционную способность и скорость реакции SE оказывает влияние структура субстрата, т. е. окружение реакционного центра.
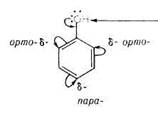
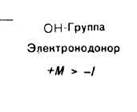
- Так, электронодонорные заместители (+I, +М-эффект) увеличивают электронную плотность в бензольном ядре, что приводит к росту реакционной способности субстрата; такие заместители ориентируют электрофил в реакциях SE в орто-, и пара-положение, (орто- и пара -ориентанты, или ориентанты I рода).
- Электроноакцепторные заместители (-М-эффект), напротив, снижают электронную плотность в бензольном кольце, что приводит к снижению реакционной способности реакционного центра субстрата; такие заместители ориентируют электрофил в .мета-положение (мета-ориентанты, или ориентанты II рода.
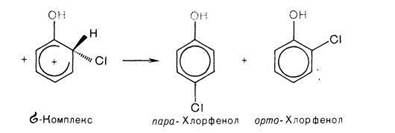
Например: хлорирование фенола протекает по механизму электрофильного замещения в ароматическом ядре через стадии образования π- и σ- комплексов. ОН группа является сильным активатором и орто-, napa-ориентантом. Это обусловливает мягкие условия реакции и образование двух продуктов с замещением в орто- и пара положениях бензольного кольца.
Реакции присоединения (А). Для ненасыщенных углеводородов характерны АЕ, для альдегидов и кетонов – АN типа.
Реакции отщепления,или элиминирования(символ Е). Эти реакции по направлению обратны реакциям присоединения. Примером может служить дегидрохлорирование трет-бутилхлорида.
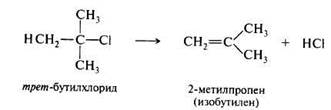
Как правило, реакции отщепления осуществляются как β-эли-минирование, т. е. когда отщепляющиеся группы, как в приведенном выше примере, уходят от соседних атомов углерода.





 Перегруппировки.В ходе перегруппировок происходит перемещение (миграция) атомов или групп от одного атома к другому.
Перегруппировки.В ходе перегруппировок происходит перемещение (миграция) атомов или групп от одного атома к другому.

Органические реакции, как правило, протекают в несколько стадий, каждая из которых характеризуется определенной скоростью. Скорость реакции в целом определяется скоростью самой медленной.
Окислительно-восстановительный характер органических реакций выявляется не так наглядно, как в случае неорганических. Под окислением в органической химии понимают введение атома кислорода в молекулу субстрата или удаление двух атомов водорода. Восстановление представляет собой обратный процесс, т.е. удаление атома кислорода или введение двух атомов водорода.
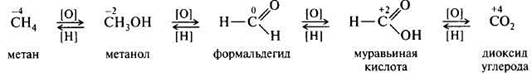
В классификации таких реакций учитывается изменение степени окисления атома углерода, являющегося реакционным центром.
Например , последовательное окисление метана до СО2
Дата добавления: 2015-08-08; просмотров: 629;
