Радикалы (R) или радикальные реагенты— незаряженные частицы, имеющие неспаренный электрон, вследствие чего являющиеся чрезвычайно реакционноспособными, например:ОН, Hal-,CH3.
2) Электрофильные (Е или Е+) реагенты — это частицы, образующие новые ковалентные связи за счет пары электронов партнера.
Положительно заряженные ионы

Нейтральные молекулы, имеющие электронодефицитный центр:
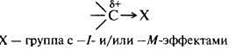
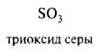
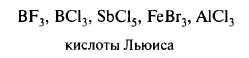
3)Нуклеофильные реагенты (Nu или Nu–) — это частицы, образующие новые ковалентные связи со своим партнером, предоставляя для этого пару электронов.
Отрицательно заряженные ион:

Нейтральные молекулы, имеющие неподеленную пару электронов

Доноры π-электронов

Типы реакции
В основе классификации реакций в органической химии лежат различные признаки:
1. Характер изменения связей в субстрате и реагенте. По этому признаку реакции подразделяют на: радикальные, ионные и согласованные (синхронные).
1.1. Радикальные реакции протекают преимущественно в случае неполярных или малополярных связей и сопровождаются расщеплением по обменному механизму (гомолизом):
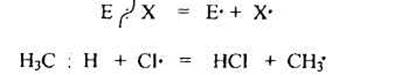
Гемолитическому разрыву связи способствует также проведение реакций в газовой фазе или в малополярных растворителях.
1.2. Ионные или гетеролитические реакции – разрыв ковалентной связи происходит неравномерно (т.е. по донорно-акцепторному механизму) и электронная пара остается у более электроотрицательного элемента, при этом образуются заряженные частицы. Частицы, обладающие избытком электронной плотности (Nu– или δ–), частицы с недостатком электронной плотности (Е+ или δ+):
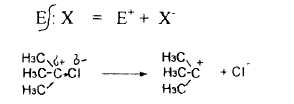
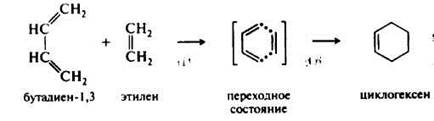
1.3. Синхронные реакции.
Разрыв старых и образование новых связей в них происходит при облучении или нагревании синхронно (одновременно), без участия ионных или радикальных частиц, например:
II. Направление реакции:
1) По направлению процесса органические реакции делят на: замещения (символ S), присоединения (А), отщепления (элиминирования Е) и перегруппирровки
Каждая из органических реакций замещения (S), присоединения (А) или элиминирования (Е) может быть электрофильной (Е), нуклеофильной (N) или радикальной (R). Таким образом, в органической химии выделяют 9 типовых реакций, обозначаемых символами S, А или Е с индексами R,N или Е:
Реакции замещения (S): Для насыщенных углеводородов характерны
SR (радикального замещения): для ароматических соединений – SE (электрофильного замещения), для карбоновых кислот, галогенпроизводных и спиртов –SN (нуклеофильного замещения).
Механизм хлорированияSR на примере метана
Реакции протекает несколько стадий,
Стадия 1. Инициирование (под действием УФ– излучения происходит распад молекулы хлора на два свободных радикала. Связь CI–CI менее прочна, чем связь C–Н, поэтому молекула хлора диссонирует легче, чем молекула метана.
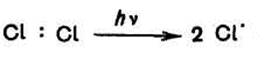
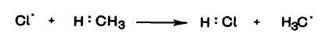
Стадия 2 Рост цепи. Радикал хлора атакует связь С—Н в молекуле метана, вырывает радикал водорода и образует нейтральную молекулу хлороводорода HCI. Связь С—Н при этом разрывается гомолитически. Молекула метана превращается в свободный метильный радикал
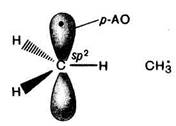
В метильном радикале атом углерода находится в состоянии sp2-гибридизации, т. е. имеет плоское строение. На негибридизованной р- орбитали находится один неспаренный электрон . Высокая реакционная способность СН3 радикала объясняется стремлением к образованию ковалентной связи с участием этого электрона и доступностью для взаимодействия р-орбитали.
СН3атакует молекулу хлора, происходит гомолитический разрыв связи и образуются молекула хлорметана и свободный радикал хлора.

Радикал хлора снова атакует молекулу метана и далее повторяются описанные выше реакции
В результате получается смесь продуктов различной степени хлорирования СН3С1, СН2С12, СНС13 и СС14. Процессы такого типа называют цепными,так как один свободный радикал хлора мог бы инициировать хлорирование всех молекул метана, имеющихся в реакционной среде.
Дата добавления: 2015-08-08; просмотров: 977;
