Взаимодействие металлов с растворами щелочей
В растворах щелочей окислительное действие оказывают также молекулы воды, но с увеличением pH окислительная способность воды уменьшается, при pH = 14 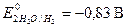 . Другое отличие поведения металлов в растворах щелочей обусловлено растворением пассивиру ющих плёнок на металлах, оксиды которых амфотерны. Таким образом, в растворах щелочей растворяются металлы, потенциалы которых меньше -0,83В, а оксиды и гидроксиды амфотерны.
. Другое отличие поведения металлов в растворах щелочей обусловлено растворением пассивиру ющих плёнок на металлах, оксиды которых амфотерны. Таким образом, в растворах щелочей растворяются металлы, потенциалы которых меньше -0,83В, а оксиды и гидроксиды амфотерны.
Пример. Al + NaOH + H2O ®
в-ль ок-ль
В водных растворах щелочей роль окислителя выполняет вода, 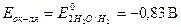 . Выписываем потенциал алюминия в щелочной среде:
. Выписываем потенциал алюминия в щелочной среде: 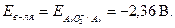 Реакция взаимодействия алюминия с раствором щёлочи возможна,
Реакция взаимодействия алюминия с раствором щёлочи возможна, 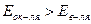 . Другим условием взаимодействия является растворимость гидроксида и оксида металла в растворе щёлочи, это условие выполняется, так как оксид и гидроксид алюминия амфотерны. Таким образом, алюминий реагирует с раствором едкого натра:
. Другим условием взаимодействия является растворимость гидроксида и оксида металла в растворе щёлочи, это условие выполняется, так как оксид и гидроксид алюминия амфотерны. Таким образом, алюминий реагирует с раствором едкого натра:
 2 Al - 3
2 Al - 3 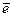 + 4OH- = AlO2- + 2H2O
+ 4OH- = AlO2- + 2H2O
 3 2H2O + 2
3 2H2O + 2 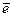 = H2 + 2OH-
= H2 + 2OH-
2Al + 8OH- + 6H2O = 2AlO2- + 4H2O + 3H2 + 6OH-

 2Al + 2OH- + 2H2O = 2AlO2- + 3H2,
2Al + 2OH- + 2H2O = 2AlO2- + 3H2,
2Na+ 2Na+
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2.
Выше рассмотрены лишь общие закономерности взаимодействия металлов с водой, растворами кислот и щелочей. При анализе поведения металла в той или иной среде необходимо также учитывать его индивидуальные особенности.
Дата добавления: 2015-08-08; просмотров: 2214;
