Механизм люминесценции и правило Стокса
Пусть на люминофор падает свет, спектр которого схематически изображен на рис. 35.
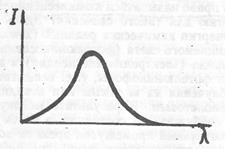
Рис. 35. Спектр возбуждающего света
Световой поток можно представить как поток квантов с различной энергией
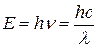
В зависимости от своей энергии эти кванты переводят атомы в различные возбужденные состояния — переходы 1→2 на рис. 36.
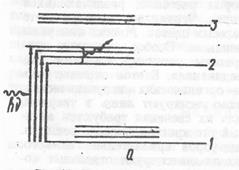
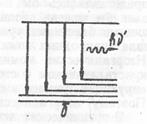
Рис. 36. Электронные и колебательные уровни в атоме люминофора. Возбуждение люминофора (а) и излучение (б)
Затем молекула вследствие соударений с другими молекулами отдает без излучения часть энергии, вследствие чего все электроны оказываются на уровне 2. Этот уровень является возбужденным, поэтому через некоторое время электроны переходят на нижний стабильный уровень, излучая кванты света. Энергия этих квантов будет, очевидно, меньше энергии квантов возбуждающего света.
hv' < hv
Соответственно, длины волн люминесценции всегда больше, чем длина волн возбуждающего света λ'>λ. Это правило называется правилом Стокса. Поэтому спектр люминесценции окажется сдвинут вправо, в сторону больших длин волн (рис. 37).
Ультрафиолетовые лучи могут вызвать синюю люминесценцию, синие лучи — зеленую, зеленые — красную.
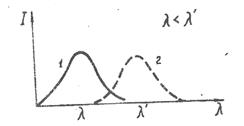
Рис. 37. Спектр возбуждающего света (1)
и спектр люминесценции (2)
Важно подчеркнуть, что вид спектра люминесценции данного вещества является характерным для данного спектра люминофора и не зависит от спектра возбуждающего света. Благодаря этому люминесценцию можно использовать как метод идентификации веществ.
Дата добавления: 2015-08-08; просмотров: 945;
