Химические свойства металлов
Общие представления о химической устойчивости металлов. Металлы и их сплавы – важнейшие конструкционные материалы. Чтобы иметь представление о химической устойчивости этих материалов, необходимо знать свойства металлов, их поведение в различных средах. Химические свойства металлов объясняются следующими особенностями.
Все металлы – восстановители, что обусловлено строением их атомов. Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо – атомы металлов характеризуются низкими энергиями ионизации и близким к нулю или отрицательным сродством к электрону. Именно поэтому металлы легко отдают валентные электроны, выступая в качестве восстановителей и превращаясь в положительные ионы и, как правило, не способны присоединять электроны – проявлять окислительные свойства.
Все металлы по восстановительным свойствам разделены на три группы:
1) активные металлы (в «Ряду напряжений» находятся от Li до Al включительно);
2) металлы средней активности (в ряду напряжений находятся от Al до H2);
3) малоактивные металлы (в ряду напряжений стоят после водорода).
Будучи восстановителями, металлы могут взаимодействовать с окислителями. Важнейшим окислителем, входящим в состав воздуха, является кислород. С кислородом взаимодействуют почти все металлы, кроме Ag, Au, Hg и платиновых металлов, причём щелочные и щелочноземельные взаимодействуют очень активно, так что уже при обычной температуре рубидий и цезий самовозгораются:
4Cs + O2 = 2Cs2O.
Хотя процессы взаимодействия других металлов с кислородом протекают менее активно, их окисление всегда термодинамически выгодно, т.к. сопровождается уменьшением свободной энергии Гиббса. Образующиеся при этом оксиды во многих случаях придают химическую устойчивость изделиям из металла.
Термодинамическая возможность реакции металла с тем или иным окислителем определяется условием 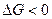 или ЭДС реакции (Е = jо - jв ) положительна. Сравнение ряда потенциалов окислителей:
или ЭДС реакции (Е = jо - jв ) положительна. Сравнение ряда потенциалов окислителей:
F2/2F 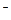
| Cl2/2Cl 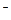
| Br2/2Br 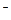
| O2/OH 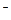
| H2O, H 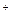 /H2 /H2
|
| +2,87 | +1,356 | +1,087 | +1,23 (рН=0) | 0,0 (рН=0) |
| +0,82 (рН=7) | -0,41 (рН=7) |
с электродными потенциалами металлов позволяет сделать следующие выводы. Все металлы окисляются фтором и могут окисляться хлором. Большинство металлов (кроме платины и золота) могут окисляться бромом и кислородом в кислой среде. В нейтральной среде кислород не может окислять золото, платиновые металлы, ртуть, серебро. Ионы водорода в кислой среде могут окислять многие металлы, кроме платиновых, ртути, золота, серебра, меди, рения, сурьмы и висмута. Реальная возможность окисления того или иного металла определяется не только термодинамикой, но и кинетикой процесса. Взаимодействие многих металлов с окислителями тормозится пассивными пленками на поверхности металлов.
Взаимодействие металлов с водой. Окислителем в этом случае является катион водорода (ион гидроксония Н3О+), присутствующий в результате равновесной реакции Н2О D Н+ + ОН 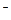 .
.
Схема ОВР:
Me + H2O ® H2 + Me(OH)n
Me – n 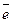 ® Men+
® Men+
2H2O + 2 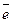 ® H2 + 2OH
® H2 + 2OH 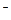 .
.
Для того чтобы выяснить, какие металлы окисляются катионами водорода, концентрация которых обусловлена диссоциацией молекул воды, необходимо определить окислительно-востановительный потенциал водородного электрода в воде. При 25оС и рН = 7 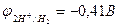 , Е =
, Е = 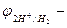
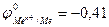
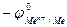 . ЭДС реакции будет положительна (Е > 0), если
. ЭДС реакции будет положительна (Е > 0), если  < - 0,41В. Значит, все металлы, имеющие стандартный электродный потенциал меньший, чем – 0,41В (в «Ряду напряжений» стоят до кадмия включительно), могут окисляться катионами водорода, т.е. восстанавливать водород из воды.
< - 0,41В. Значит, все металлы, имеющие стандартный электродный потенциал меньший, чем – 0,41В (в «Ряду напряжений» стоят до кадмия включительно), могут окисляться катионами водорода, т.е. восстанавливать водород из воды.
Чтобы процесс мог протекать до конца, необходимо, чтобы образующиеся гидроксиды Me(OH)n были растворимы в воде. В противном случае, вследствие образования малорастворимых оснований, покрывающих металл, реакция практически прекращается.
Примеры:
1. 2Na + 2H2O ® H2 + 2NaOH

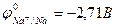 < - 0,41B
< - 0,41B
2 Na – eˉ = Na+
1 2H2O + 2е = H2# + 2OH-

2Na + 2H2O ® 2 Na+ + H2 + 2OH  .
.
2. Zn +2 H2O ® H2 + Zn(OH)2¯
Процесс термодинамически возможен, т.к. 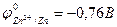 < - 0,41B, но из-за образования малорастворимого Zn(OH)2, предохраняющего цинк от воздействия воды, практически не идёт.
< - 0,41B, но из-за образования малорастворимого Zn(OH)2, предохраняющего цинк от воздействия воды, практически не идёт.
3. Cu + H2O 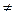
Процесс термодинамически не возможен, т.к. 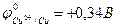 > - 0,41B.
> - 0,41B.
Приведённые выше расчёты указывают лишь на возможность осуществления процесса, а не на обязательное его протекание. В действительности существуют ограничения, которые препятствуют реализации такой возможности, а иногда полностью её исключают. Например, пассивацию поверхности металла малорастворимым соединением, в частности основанием, мы уже рассмотрели. На возможность реального осуществления реакции влияет реальное состояние поверхности (наличие оксидных плёнок). Так, в соответствии с электродными потенциалами металлы Be, Mg, Al, Ti и др. должны взаимодействовать с водой (восстанавливать катионы водорода из воды). Однако оксидные поверхностные слои, не растворимые в воде, исключают возможность такого взаимодействия. Нерастворимость TiO2 ни в воде, ни в разбавленных растворах кислот и щелочей обусловливает высокую химическую пассивность титана.
Взаимодействие металлов с растворами щелочей. Только амфотерные металлы Be, Al, Zn, Pb, Sn могут взаимодействовать с растворами щелочей по ионно-молекулярной схеме:
Мe + H2O + OH 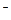
 H2
H2  + [Мe(OH)n]m-,
+ [Мe(OH)n]m-,
где n, m – степень окисления металла и заряд комплексного иона, соответственно.
В качестве примера рассмотрим взаимодействие бериллия с раствором гидроксида натрия. Схема процесса:
Be0 + H2O + NaOH  H2
H2  + Na2[Be(OH)4]
+ Na2[Be(OH)4]
или
Be0 + H2O + OH 
 H2
H2  + [Be(OH)4]2-
+ [Be(OH)4]2-
в-ль ок-ль продукт продукт
в-ния ок-ия
Схемы полуреакций и ионно-молекулярное уравнение:
 1 Be + 4OH
1 Be + 4OH  – 2eˉ = [Be(OH)4]2-
– 2eˉ = [Be(OH)4]2-
1 2H2O + 2eˉ = H2 + 2OH 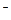
 Be + 4OH
Be + 4OH 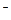 + 2H2O = [Be(OH)4]2- + H2 + 2OH
+ 2H2O = [Be(OH)4]2- + H2 + 2OH 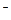
Be + 2OH 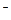 + 2H2O = [Be(OH)4]2- + H2
+ 2H2O = [Be(OH)4]2- + H2
Молекулярное уравнение:
Be0 + 2H2O + 2NaOH = H2 + Na2[Be(OH)4] .
Для определения металлов, восстанавливающих водород из щелочных растворов, т.е. для расчёта ЭДС реакции нельзя пользоваться потенциалами окислительно-восстановительных систем  , т.к. металл, окисляясь, переходит в значительно более сложный ион – [Me(OH)n]m- . В подобных случаях надо рассматривать потенциал системы [Me(OH)n]m-/Ме.
, т.к. металл, окисляясь, переходит в значительно более сложный ион – [Me(OH)n]m- . В подобных случаях надо рассматривать потенциал системы [Me(OH)n]m-/Ме.
Кроме того, концентрация [H+] в щелочном растворе зависит от концентрации щелочи. Например, для 1М раствора NaOH [OH 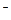 ] = 1 моль/л; при 25 0С [H+] =
] = 1 моль/л; при 25 0С [H+] = 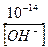 = 10-14 моль/л. Отсюда
= 10-14 моль/л. Отсюда 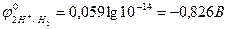 .
.
Взаимодействие металлов с растворами кислот.Минеральные кислоты HCl, H3PO4, H2SO4 разбавленная и др., за исключением HNO3 любой концентрации и H2SO4 концентрированной, являются окислителями металлов за счёт катионов водорода.
Для перечисленных кислот взаимодействие с металлами идёт по схеме:
Ме + 2Н+ ® Меn+ + H2
Определим ЭДС данной ОВР в общем виде в стандартных условиях:
Ео = 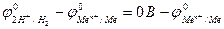
Чтобы металл мог восстанавливать катионы Н+ до Н2 при взаимодействии с перечисленными минеральными кислотами, необходимо, чтобы его стандартный электродный потенциал  был меньше нуля вольт и образующаяся соль была растворимой в воде (реакция будет идти до конца; в противном случае поверхность металла запассивируется).
был меньше нуля вольт и образующаяся соль была растворимой в воде (реакция будет идти до конца; в противном случае поверхность металла запассивируется).
Примеры:
1. Zn + 2HCl ® H2 + ZnCl2

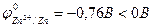 , процесс термодинамически возможен.
, процесс термодинамически возможен.
1 Zn – 2eˉ = Zn2+
1 2H+ + 2eˉ = H2

Zn + 2H+ = Zn2+ + H2
2. Pb + H2SO4 = PbSO4¯ + H2
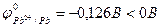 , процесс возможен, но образующаяся в начальный момент малорастворимая соль PbSO4 покрывает металл пассивирующей солевой плёнкой и реакция практически прекращается.
, процесс возможен, но образующаяся в начальный момент малорастворимая соль PbSO4 покрывает металл пассивирующей солевой плёнкой и реакция практически прекращается.
Особенности взаимодействия металлов с растворами азотной кислоты. В азотной кислоте сильным окислителем является нитрат- ион NO  , поэтому при её взаимодействии с металлами водород Н2 не выделяется, а протекает восстановление NO
, поэтому при её взаимодействии с металлами водород Н2 не выделяется, а протекает восстановление NO  . Каким будет продукт восстановления - зависит от концентрации кислоты и активности металла.
. Каким будет продукт восстановления - зависит от концентрации кислоты и активности металла.
Чем активнее металл и чем меньше концентрация кислоты, тем в большей степени восстанавливается азот (понижается его степень окисления). Азотная кислота как сильный окислитель окисляет металлы до высоких степеней окисления, взаимодействует со всеми металлами, стоящими в «Ряду напряжений», по серебро включительно.
В зависимости от концентрации кислоты и активности металла получаются следующие продукты:
-3
HNO3 + Me(акт) = NH4NO3 + Me(NO3)n + H2O
Дата добавления: 2015-08-08; просмотров: 1249;
