Комплексные соединения
Комплексными называют соединения, в узлах кристаллов которых находятся комплексы (комплексные ионы), способные к самостоятельному существованию.
Значение комплексных соединений для различных областей техники очень велико. Способность веществ образовывать комплексные соединения используется для разработки эффективных методов получения химически чистых металлов из руд, редких металлов, сверхчистых полупроводниковых материалов, катализаторов, красителей, лекарственных препаратов, очистки природных и сточных вод, растворения накипи в парогенераторах и т.п.
Первые комплексные соединения были синтезированы в середине 19 века. Основоположником теории комплексных соединений стал швейцарский ученый Вернер, разработавший в 1893 г. координационную теорию. Большой вклад в химию комплексных соединений внесли русские ученые Л.А. Чугаев, И.И. Черняев и их ученики.
Структура комплексных соединений:
1. В каждом комплексном соединении различают внутреннюю и внешнюю сферы. Внутреннюю сферу называют комплексом. При написании химических формул комплексных соединений внутреннюю сферу заключают в квадратные скобки. Например, в комплексных соединениях а) К2[ВеF4], б) [Zn(NH3)4]Cl2, внутреннюю сферу составляют группировки атомов – комплексы а) [ВеF4]2– и б) [Zn(NH3)4]2+, а внешнюю сферу составляют соответственно ионы а) 2К+ и б) 2Сl–.
2. В молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, или атом внутренней среды занимает центральное место и называется комплексообразователем. В формуле комплекса (внутренней сферы) комплексообразователь указывается первым. В приведенных примерах это ионы а) Ве2+ и б) Zn2+.
Комплексообразователями являются атомы или чаще ионы металлов, относящиеся к p-, d-, f- элементам и имеющие достаточное число свободных орбиталей (Cu2+, Pt2+, Pt4+, Ag+, Zn2+, Al3+ и т.д.).
3. Вокруг комплексообразователя расположено (или, как говорят, координировано) некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами (или аддендами). В данном случае это а) ионы F– и б) молекулы NН3.
Лигандами в комплексных соединениях могут служить анионы F– , OH–, CN–, CNS–, NO2–, CO32–, C2O42– и др., нейтральные молекулы Н2О, NН3, СО, NО и др.
Число координационных мест, занятых лигандами вокруг комплексообразователя (в простейших случаях - число лигандов, окружающих комплексообразователь), называется координационным числом (к.ч.) комплексообразователя. Координационные числа различных комплексообразователей имеют значение от 2 до 12.
Ниже сопоставлены наиболее характерные координационные числа в растворах и заряд центрального иона (комплексообразователя):
| Заряд комплексообразователя | +1 | +2 | +3 | +4 |
| к.ч. | 4, 6 | 6, 4 |
Примечание: подчеркнуты чаще встречающиеся координационные числа в тех случаях, когда возможны два различных типа координации.
В рассмотренных примерах координационные числа комплексообразователей составляют: а) к.ч. (Ве2+) = 4, б) к.ч. (Zn2+) = 4.
Лиганды, занимающие во внутренней координационной сфере одно координационное место, называются монодентатными. Лиганды, занимающие во внутренней сфере два или несколько мест (до восьми) за счет образования с комплексообразователем соответствующего числа химических связей, называются полидентатными. Примерами монодентатных лигандов являются ионы Сl–, F–, ОН–, молекулы NН3, Н2О, СО и др. В качестве бидентатных лигандов часто выступают ионы СО32–, SО42– и им подобные. Одним из наиболее важных полидентатных лигандов (гексадентатным) является анион этилендиаминтетрауксусной кислоты (ЭДТА):


Комплексообразователь и лиганды образуют внутреннюю координационную сферу соединения или комплекс.
Заряд комплекса равен алгебраической сумме зарядов комплексообразователя и лигандов; при этом заряд комплексообразователя принимается равным его степени окисления.
4. Ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от комплексообразователя (центрального иона) и составляют внешнюю координационную сферу.
Внешняя сфера содержит положительно заряженные ионы, если внутренняя сфера комплексного соединения заряжена отрицательно, или отрицательные заряженные ионы, если комплексный ион заряжен положительно. В случае незаряженной внутренней сферы внешняя сфера отсутствует.
Заряд внешней сферы численно равен суммарному заряду внутренней сферы и противоположен ему по знаку. Например, во внешней сфере комплексного соединения К3[Fe(CN)6] находятся три положительно заряженных иона К+. Следовательно, заряд комплекса (комплексного иона) равен (-3): [Fe(CN)6]3–.
Заряд комплексообразователя равен и противоположен по знаку алгебраической сумме зарядов всех остальных ионов. Так, в комплексном соединении К3[Fe(CN)6] заряд иона железа равен (+3). Сумма зарядов всех частиц, входящих в комплексное соединение, равняется нулю.
Номенклатура комплексных соединений.Названия комплексных соединений (солей) образуют по общему правилу: сначала называют анион, а затем – катион в родительном падеже.
1.Название комплексного катионасоставляют следующим образом:
А. Сначала указывают числа (используя греческие числительные) и названия анионных (отрицательно заряженных) лигандов с окончанием «о».
Греческие числительные:
| моно | ди | три | тетра | пента | гекса | гепта | окта | нона | дека |
Названия анионных лигандов:
| Сl– | CN– | SО32– | SО42– | ОН– | NО2– | СNS– | СО32– | N3– |
| хлоро | циано | сульфито | сульфато | гидроксо | нитро | родано | карбонато | азидо |
Б. Затем называют числа и названия нейтральных лигандов:
| Н2О | NН3 | СО | NO |
| аква | аммин | карбонил | нитрозил |
В. Последним называется комплексообразователь в родительном падеже с указанием степени его окисления (в скобках римскими цифрами после названия комплексообразователя).
Например, [Pt(NH3)3Cl]Cl – хлорид хлоротриамминплатины (II).
Если металл образует ион с одной степенью окисления, то она в название комплекса может не входить. Например, [Zn(NH3)4]Cl2 – дихлорид тетраамминцинка.
2. Название комплексного анионаобразуется аналогичным образом, с добавлением суффикса «ат» к корню латинского названия комплексообразователя (например, феррат, никелат, хромат, кобальтат, купрат и т.д.). Например:
K2[PtCl6] – гексахлороплатинат (IV) калия;
Ba[Cr(NH3)2(SCN)4]2 – тетрароданодиамминхромат (III) бария;
K3[Fe(CN)6] – гексацианоферрат (III) калия;
K2[BeF4] – тетрафторобериллат калия.
3. Названия нейтральных комплексных частиц образуются так же, как и катионов, но комплексообразователь называют в именительном падеже, а степень его окисления не указывают, т.к. она определяется электронейтральностью комплекса. Например:
[Pt(NH3)2Cl2] – дихлородиамминплатина;
[Ni(CO)4] – тетракарбонилникель.
Классификация комплексных соединений.Комплексные соединения очень разнообразны по строению и свойствам. Системы их классификации основываются на различных принципах:
1. По характеру электрического заряда различают катионные, анионные и нейтральные комплексы.
Комплекс с положительным зарядом называют катионным, например [Cu(NН3)4]2+, с отрицательным зарядом – анионным, например [Cd(СN)4]2–, с нулевым зарядом – нейтральным, например [Fе(СО)5].
2. По типу лигандов различают:
А. Аквакомплексы или гидраты – комплексные соединения, в которых лигандами являются молекулы воды. Например: [Cr(H2O)6]Cl3 – хлорид гексааквахрома (III); [Co(H2O)6]Cl2 – хлорид гексааквакобальта (II).
Б. Аммиакаты – комплексные соединения, в которых лигандами являются молекулы аммиака (NН3). Например:
[Zn(NH3)4]SO4 – сульфат тетраамминцинка;
[Ag(NH3)2]Cl – хлорид диамминсеребра (I).
В. Карбонилы металлов – комплексные соединения, в которых лигандами служат молекулы оксида углерода (II). Например, [Fe(CO)5] – пентакарбонилжелезо.
Г. Ацидокомплексы – комплексные соединения, в которых лигандами являются кислотные остатки - анионы каких-либо кислот (F–, Cl–, Br–, I–, CN–, NO2–, SO42–, PO43– и др.). К ацидокомплексам относятся двойные соли и гидроксокомплексы (у них лиганд гидроксид – ион ОН–).
Между этими классами существуют переходные ряды, которые включают комплексы с различными лигандами. Например: К[Pt(NH3)3Cl3] – трихлоротриамминплатинат (II) калия. 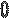
3. По химическим свойствам различают кислоты, основания, соли, неэлектролиты:
а) кислоты, например:
H[AuCl4] – тетрахлороаурат (III) водорода;
H2[PtCl6] – гексахлороплатинат (IV) водорода;
б) основания, например:
[Cu(NH3)4](OH)2 – гидроксид тетраамминмеди (II);
[Ag(NH3)2]OH – гидроксид диамминсеребра;
в) соли, например:
K3[Al(OH)6] – гексагидроксоалюминат калия;
[Cr(H2O)6]Cl3 – хлорид гексааквахрома (III);
г) неэлектролиты, например, [Pt(NH3)2Cl2] – дихлородиамминплатина.
Образование химических связей в комплексных соединениях.Для объяснения образования и свойств комплексных соединений в настоящее время применяют ряд теорий:
1) метод валентных связей (МВС);
2) теория кристаллического поля;
3) метод молекулярных орбиталей.
Согласно МВС при образовании комплексов между комплексообразователем и лигандами возникает ковалентная связь по донорно-акцепторному механизму. Комплексообразователи имеют вакантные орбитали, т.е. играют роль акцепторов. Как правило, в образовании связей участвуют различные вакантные орбитали комплексообразователя, поэтому происходит их гибридизация. Лиганды имеют неподеленные пары электронов и играют роль доноров в донорно-акцепторном механизме образования ковалентной связи.
Для примера рассмотрим образование комплекса [Zn(NH3)4]2+. Электронные формулы валентных электронов:
- атома Zn – 3d10 4s2;
- комплексообразователя иона цинка

Zn2+ – 3d10 4s0
3d 4s 4p
Как видно, у иона цинка на внешнем электронном уровне имеются четыре близкие по энергии вакантные атомные орбитали (одна 4s и три 4р), которые будут подвергаться sр3- гибридизации; ион Zn2+, как комплексообразователь, имеет к.ч.=4.
При взаимодействии иона цинка с молекулами аммиака, атомы азота которого имеют неподеленные пары электронов (:NН3), образуется комплекс:


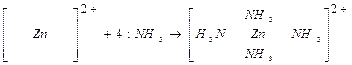
Пространственная структура комплекса определяется типом гибридизации атомных орбиталей комплексообразователя (в данном случае тетраэдр). Координационное число зависит от числа вакантных орбиталей комплексообразователя.
При образовании донорно-акцепторных связей в комплексах могут использоваться не только s- и р- орбитали, но и d- орбитали. В этих случаях происходит гибридизация с участием d-орбиталей. Ниже в таблице приведены некоторые виды гибридизации и соответствующие им пространственные структуры:
| Гибридизация | Структура комплекса | Комплексообразователь |
| sp | Линейная | Ag+, Сu 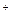
|
| sp3 | Тетраэдрическая | Al3+, Zn2+, Co2+, Ti3+, Fe2+, Ni2+ |
| sp2d | Плоская квадратная | Pt2+, Pd2+, Cu2+, Ni2+, Au3+ |
| sp3d2 | Октаэдрическая | Cr3+, Co3+, Ni2+, Pd4+, Pt4+ |
Таким образом, МВС позволяет предсказать состав и структуру комплекса. Однако этот метод не может объяснить такие свойства комплексов, как прочность, цвет и магнитные свойства. Вышеуказанные свойства комплексных соединений описывает теория кристаллического поля.
Диссоциация комплексных соединений в растворах. Внутренняя и внешняя сфера комплексного соединения сильно различаются по устойчивости.
Частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами (ионная связь) и легко отщепляются в водном растворе подобно ионам сильных электролитов.
Диссоциация (распад) комплексного соединения на ионы внешней сферы и комплексный ион (комплекс) называется первичной. Она протекает почти нацело, до конца, по типу диссоциации сильных электролитов.
Например, процесс первичной диссоциации при растворении тетрафторобериллата калия может быть записан по схеме:
К2[ВеF4] = 2К+ + [ВеF4]2–.
Лиганды, находящиеся во внутренней сфере комплексного соединения, связаны с комплексообразователем прочными ковалентными связями, образованными по донорно-акцепторному механизму, и диссоциация комплексных ионов в растворе осуществляется, как правило, в незначительной степени по типу диссоциации слабых электролитов, т.е. обратимо до установления состояния равновесия. Обратимый распад внутренней сферы комплексного соединения носит название вторичной диссоциации. Например, ион тетрафторобериллат диссоциирует лишь частично, что выражается уравнением
[ВеF4]2– D Ве2+ + 4F– (уравнение вторичной диссоциации).
Диссоциация комплекса как обратимый процесс характеризуется константой равновесия, называемой константой нестойкости комплекса Кн.
Для рассматриваемого примера
 .
.
Кн – табличная (справочная) величина. Константы нестойкости, в выражения которых входят концентрации ионов и молекул, называются концентрационными. Более строгими и не зависящими от состава и ионной силы раствора являются Кн, содержащие вместо концентрации активности ионов и молекул.
Значения Кн различных комплексов колеблются в широких пределах и могут служить мерой их устойчивости. Чем устойчивее комплексный ион, тем меньше его константа нестойкости.
Так, среди однотипных соединений, обладающих различными значениями констант нестойкости
| Комплекс: | [Ag(NO2)2]– | [Ag(NН3)2]+ | [Ag(СN)2]– |
| Кн: | 1,3·10–3 | 6,8·10–8 | 1·10–21 |
наиболее устойчив комплекс [Ag(СN)2]–, а наименее устойчив [Ag(NO2)2]–.
Как и любая константа равновесия, константа нестойкости зависит только от природы комплексного иона, комплексообразователя и лигандов, растворителя, а также от температуры и не зависит от концентрации (активности) веществ в растворе.
Чем больше заряды комплексообразователя и лигандов и чем меньше их радиусы, тем выше устойчивость комплексов. Прочность комплексных ионов, образованных металлами побочных подгрупп, выше прочности ионов, образованных металлами главных подгрупп.
Процесс распада комплексных ионов в растворе протекает многоступенчато, с последовательным отщеплением лигандов. Например, диссоциация иона аммиаката меди (II) [Cu(NН3)4]2+ происходит по четырем ступеням, соответствующим отрыву одной, двух, трех и четырех молекул аммиака:
| [Cu(NН3)4]2+ D [Cu(NН3)3]2+ + NH3 | КД1 = 7,2·10–3 |
| [Cu(NН3)3]2+ D [Cu(NН3)2]2+ + NH3 | КД2 = 1,3·10–3 |
| [Cu(NН3)2]2+ D [Cu(NН3)]2+ + NH3 | КД3 = 3,2·10–4 |
| [Cu(NН3)]2+ D Cu2+ + NH3 | КД4 = 7,1·10–5 |
| [Cu(NН3)4]2+ D Cu2+ + 4NH3 | КН |
Для сравнительной оценки прочности различных комплексных ионов пользуются не константой диссоциации отдельных ступеней, а общей константой нестойкости всего комплекса, которую определяют перемножением соответствующих констант ступенчатой диссоциации. Например, константа нестойкости иона [Cu(NH3)4]2+ будет равна:
KH = KД1· KД2· KД3·KД4 = 2,1·10–13.
Для характеристики прочности (устойчивости) комплексов применяют также величину, обратную константе нестойкости, ее называют константой устойчивости (Куст) или константой образования комплекса:
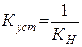 .
.
Равновесие диссоциации комплексного иона может смещаться избытком лигандов в сторону его образования, а уменьшение концентрации одного из продуктов диссоциации, наоборот, может привести к полному разрушения комплекса.
С помощью качественных химических реакций обычно обнаруживаются только ионы внешней сферы или комплексные ионы. Хотя все зависит от произведения растворимости (ПР) соли, образование которой протекало бы при добавлении соответствующих растворов в качественных реакциях. В этом можно убедиться на основании следующих реакций. Если на раствор, содержащий комплексный ион [Ag(NН3)2]+, подействовать раствором какого-нибудь хлорида, то осадка не образуется, хотя из растворов обычных солей серебра при добавлении хлоридов выделяется осадок хлорида серебра. Очевидно, концентрация ионов серебра в растворе слишком мала, чтобы при введении в него даже избытка хлорид-ионов можно было бы достигнуть величины произведения растворимости хлорида серебра (ПРАgСl = 1,8·10–10). Однако после прибавления к раствору комплекса йодида калия выпадает осадок йодида серебра. Это доказывает, что ионы серебра все же имеются в растворе. Как ни мала их концентрация, но она оказывается достаточной для образования осадка, т.к. ПРАgI = 1·10–16, т.е. значительно меньше, чем у хлорида серебра. Точно так же при действии раствора Н2S получается осадок сульфида серебра Аg2S, произведение растворимости которого равно 10–51.
Ионно-молекулярные уравнения протекающих реакций имеют вид:
[Ag(NН3)2]+ +I– D АgI↓ + 2NН3
2[Ag(NН3)2]+ + H2S D Ag2S↓ + 2NH3 + 2NH4+.
Комплексные соединения с малоустойчивой внутренней сферой называют двойными солями. Обозначают их иначе, а именно – как соединения молекул. Например: СаСО3·Nа2СО3; СuСl2·КСl; КСl·MgСl2; 2NaСl·СoСl2. Двойные соли можно рассматривать как соединения, в узлах кристаллической решетки которых находятся одинаковые анионы, но разные катионы; химические связи в этих соединениях носят преимущественно ионный характер и поэтому в водных растворах они диссоциируют практически полностью на отдельные ионы. Если, например, растворить в воде хлорид калия и меди (II), то происходит диссоциация по типу сильного электролита:
CuCl2·KCl = Cu2+ + 3Cl– + K+.
Все образовавшиеся в растворе двойной соли ионы можно обнаружить с помощью соответствующих качественных реакций.
Реакции в растворах комплексных соединений.Смещение равновесия в обменных реакциях в растворах электролитов с участием комплексных ионов определяется теми же правилами, что и в растворах простых (некомплексных) электролитов, а именно: равновесие смещается в направлении возможно более полного связывания ионов (комплексообразователя, лигандов, ионов внешней сферы), приводящего к образованию нерастворимых, малорастворимых веществ или слабых электролитов.
В связи с этим в растворах комплексных соединений возможны реакции: 1) обмена ионов внешней сферы, при котором состав комплексного иона остается постоянным; 2) внутрисферного обмена.
Первый тип реакции реализуется в тех случаях, когда это приводит к образованию нерастворимых и малорастворимых соединений. Примером может быть взаимодействие K4[Fe(CN)6] и K3[Fe(CN)6] соответственно с катионами Fе3+ и Fе2+, которое дает осадок берлинской лазури Fe4[Fe(CN)6]3 и турнбулевой сини Fe3[Fe(CN)6]2:
3[Fe(CN)6]4– + 4Fe3+ = Fe4[Fe(CN)6]3↓,
берлинская лазурь
2[Fe(CN)6]3– + 3Fe2+ = Fe3[Fe(CN)6]2↓.
турнбулева синь
Реакции второго типа возможны в тех случаях, когда это приводит к образованию более устойчивого комплекса, т.е. с меньшим значением Кн,например:
 [Ag(NН3)2]+ + 2S2O32– D [Ag(S2O3)2]3– + 2NН3.
[Ag(NН3)2]+ + 2S2O32– D [Ag(S2O3)2]3– + 2NН3.
Кн: 9,3·10-8 1·10–13
При близких значениях Кн возможность такого процесса определяется избытком конкурирующего лиганда.
Для комплексных соединений возможны и окислительно-восстановительные реакции, проходящие без изменения атомного состава комплексного иона, но с изменением его заряда, например:
2K3[Fe(CN)6] + H2O2 + 2KOH = 2 K4[Fe(CN)6] + O2 + 2H2O.
Дата добавления: 2015-08-08; просмотров: 1940;
