Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
Последовательность заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах определяют:
1) принцип наименьшей энергии;
2) правило Клечковского;
3) принцип запрета Паули;
4) правило Гунда.
Принцип наименьшей энергии:максимуму устойчивости системы соответствует минимум её энергии.
Следовательно, в соответствии с данным принципом электроны будут вначале располагаться на атомных орбиталях, имеющих минимальную энергию, в этом случае связь электронов с ядром наиболее прочная и атомная система находится в состоянии максимальной устойчивости.
 В многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание электронов, находящихся ближе к ядру и экранирующих ядро от более далеко расположенных электронов. Поэтому последовательность возрастания энергии орбиталей усложняется.
В многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание электронов, находящихся ближе к ядру и экранирующих ядро от более далеко расположенных электронов. Поэтому последовательность возрастания энергии орбиталей усложняется.
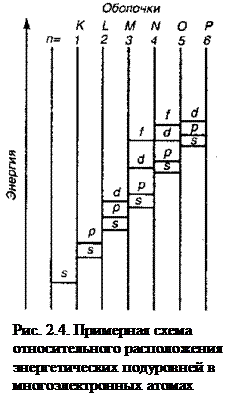
Порядок возрастания энергии атомных орбиталей в сложных атомах описывается правилом Клечковского: при увеличении заряда ядра атома заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n+l), а при равных значениях суммы (n+l) – в порядке возрастания n.
Соответственно этому правилу подуровни выстраиваются в следующий ряд (рис. 2.4.): 1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈4f≈5d<6p<7s≈5f≈6d.
Например:
| Подуровни | 3d | 4s | 4p |
| n | |||
| l | |||
| n+l |
Порядок заполнения: 4s, 3d, 4p.
Исключение составляют d и f – элементы с полностью и наполовину заполненными подуровнями, у которых наблюдается так называемый провал электронов, например: Cu, Ag, Cr, Mo, Pd, Pt (это явление будет рассмотрено позднее).
Принцип запрета Паули гласит: в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел.
 Согласно этому принципу, на одной орбитали, характеризуемой определенными значениями трех квантовых чисел n, l и ml, могут находиться только два электрона, отличающихся значением спинового квантового числа ms, а именно ms=+
Согласно этому принципу, на одной орбитали, характеризуемой определенными значениями трех квантовых чисел n, l и ml, могут находиться только два электрона, отличающихся значением спинового квантового числа ms, а именно ms=+ 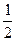 и ms= –
и ms= – 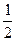 , т.е. спины которых противоположно направлены.Это можно символически представить следующей схемой .
, т.е. спины которых противоположно направлены.Это можно символически представить следующей схемой .

 Заполнение и не допускается.
Заполнение и не допускается.
Принцип запрета Паули определяет электронную емкость энергетических уровней и подуровней. На s – подуровне (одна орбиталь) может быть лишь два электрона, на p – подуровне (три орбитали) – шесть, на d подуровне (пять орбиталей) – десять, на f – подуровне (семь орбиталей) – четырнадцать электронов. Вообще, максимальное число электронов на подуровне с орбитальным квантовым числом l равно 2(2l+1). Поскольку число орбиталей данного энергетического уровня равно n2, емкость энергетического уровня составляет 2n2 электронов, где n – соответствующее значение главного квантового числа.
Правило Гунда:устойчивому (невозбужденному) состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спинового числа их (│∑ms│) максимально.
Рассмотрим распределение электронов по энергетическим ячейкам в атоме углерода, электронная конфигурация которого 1s22s22p2. Возможны три варианта:








 а) б) в)
а) б) в)
1s 2s 2p 1s 2s 2p 1s 2s 2p
∑ms= 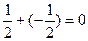 ∑ms =+
∑ms =+ 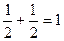 ∑ms=0
∑ms=0
Во всех вариантах спиновое число 1s2 и 2s2 – электронов равно 0 (спины электронов антипараллельны в каждой энергетической ячейке). Суммарное спиновое число p – электронов в вариантах a), в) равно нулю (∑ms =0), в варианте (б) ∑ms=1. В соответствии с правилом Гунда реализуется только вариант (б).
Другими словами: заполнение орбиталей одного подуровня в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. После того как одиночные электроны займут все орбитали в данном подуровне, заполняются орбитали вторыми электронами с противоположными спинами.
Дата добавления: 2015-08-08; просмотров: 1271;
