СОВРЕМЕННАЯ ТЕОРИЯ СТРОЕНИЯ АТОМА. ПЕРИОДИЧЕСКИЙ ЗАКОН И СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Общие положения
Согласно современным представлениям, атом – это наименьшая частица химического элемента, являющаяся носителем его химических свойств. Атом электрически нейтрален и состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые движутся определённым образом вокруг ядра. Ядро атома, не изменяющееся в ходе химических реакций, составляет его фундаментальную основу и определяет индивидуальность элемента. Поэтому значение заряда ядра выбрали за основной признак, по которому атомы относят к разным видам – химическим элементам.
Ядра атомов включают два вида элементарных частиц: протоны и нейтроны.
Основные характеристики электрона, протона и нейтрона приведены в табл. 2.1.
Таблица 2.1
Сведения о некоторых элементарных частицах.
| Частица | Символ | Масса | Заряд | ||
| кг | а.е.м. | Кл. | Усл. | ||
| протон | p | 1, 673 10-27 | 1, 007276 | 1, 602 10-19 | +1 |
| нейтрон | n | 1, 675 10-27 | 1, 008665 | ||
| электрон | e | 9, 109 10-31 | 0, 000547 | 1, 602 10-19 | -1 |
Каждый протон несёт положительный заряд, численно равный заряду электрона. Нейтрон же не несёт никакого электрического заряда. Отсюда следует вывод: заряд ядра определяется числом протонов. Количество протонов в ядре атома совпадает с порядковым номером элемента (Z) в периодической системе элементов Д.И. Менделеева.
Как видно из данных табл. 2.1, масса электрона почти в 1840 раз меньше массы протона и нейтрона. В ядре сосредоточено 99,9% массы атома, поэтому масса атома практически равна массе ядра – сумме масс протонов и нейтронов.
Общее число протонов (Z) и нейтронов (N) в ядре называется массовым числом A:
A=Z+N.
Поскольку массы протона и нейтрона практически равны 1а.е.м., то масса атома в а.е.м., как и относительная атомная масса, численно совпадает со значением массового числа А.
Силы, удерживающие протоны и нейтроны в ядре, называют ядерными. Это чрезвычайно большие силы, действующие на очень коротких расстояниях (порядка 10-13 см) и превосходящие силы отталкивания. Природу этих сил изучает ядерная физика.
Исследования показали, что в природе атомы одного и того же элемента имеют различные атомные массы. Так, атомы хлора имеют массу 35 и 37. Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов. Атомы с одинаковым числом протонов, но с различным числом нейтронов называются изотопами. Для обозначения изотопов пользуются обычными символами соответствующих элементов, добавив к ним слева вверху индекс, указывающий массовое число изотопа, внизу – индекс, указывающий количество протонов, равное порядковому номеру (Z) элемента ( 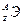 ). Пример – изотопы водорода:
). Пример – изотопы водорода:
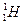 – протий (1р, 0n)
– протий (1р, 0n)
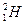 – дейтерий (1р, 1n)
– дейтерий (1р, 1n)
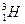 – тритий (1р, 2n)
– тритий (1р, 2n)
В периодической таблице элементов Д.И. Менделеева приводятся усреднённые значения относительных атомных масс с учётом распространённости различных изотопов в природе.
Атомы с различным числом протонов Z и нейтронов N, но с одинаковым числом нуклонов (Z+N) называются изобарами, а с одинаковым числом нейтронов (N) – изотонами.
Примеры изобаров и изотонов:
Изобары Изотоны

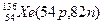
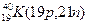
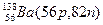
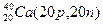

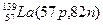
Поскольку атом в целом является электронейтральным, а заряд электрона численно равен заряду протона и противоположен ему по знаку, то общее число электронов в атоме равно числу протонов и, следовательно, равно порядковому номеру элемента в периодической системе элементов.
Дата добавления: 2015-08-08; просмотров: 599;
