Лекция 3. Основные типы химической связи. Ковалентная связь
Ключевые слова: типы химической связи: ионная, металлическая, ковалентная, σ - и 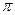 - связи, свойства ковалентной связи, механизмы образования связи, валентность.
- связи, свойства ковалентной связи, механизмы образования связи, валентность.
Под химической связью понимают силы притяжения, удерживающие атомы или (ионы) друг около друга и создающие тем самым достаточно стабильный агрегат атомов (или ионов). По современным представлениям, химическая связь имеет электростатическую природу. В ее образовании участвуют валентные электроны внешних и предвнешних подуровней атомов. Выделяют три основных типа химической связи: ковалентная, ионная, металлическая.
Ионная связьосуществляется как электростатическое притяжение противоположно заряженных ионов (простых или сложных). Принято считать связь ионной, если разность электроотрицательностей элементов больше 1,9. Ионная связь, как правило, образуется между атомами типичных металлов и типичных неметаллов. Ионная связь характеризуется ненаправленностью и ненасыщаемостью. По этой причине посредством ионной связи образуются ионные кристаллы. Состав ионного соединения AnBm отражает только соотношение между числом катионов Am+ и анионов Bn-.
Металлическая связь возникает в металлах, сплавах, интерметаллических соединениях. Валентные электроны внешних оболочек металла относительно легко удаляются, из атомов образуются катионы металла. Электроны делокализованы и могут свободно перемещаться по всему кристаллу. Оставшиеся катионы металлов притягиваются делокализованным электронным облаком («электронным газом»),заполняющим пространство между ними. Образованную подобным образом химическую связь называют металлической связью. Металлическая связь характеризуется ненаправленностью и ненасыщаемостью. Строение металлических кристаллов наиболее точно описывается «структурами с плотнейшей укладкой шаров».
Для объяснения природы ковалентной связи и механизма ее образования используются два метода – метод валентных связей (ВС) и метод молекулярных орбиталей (МО). В основе метода ВС лежит теория Льюиса об образовании ковалентной связи формированием общей пары электронов между взаимодействующими атомами. В 1927 г. немецкие физики Гейтлер и Лондон провели квантово-механический расчет с использованием уравнения Шредингера для выяснения вопроса – как изменяется энергия в системе из двух атомов водорода при их сближении. Из расчетов были получены следующие выводы: 1. Для образования химической связи атомы должны предоставить в общее пользование электроны с противоположными спинами. 2. Атомные орбитали при образовании химической связи «перекрываются». 3. При образовании химической связи выделяется энергия, называемая энергией связи, что является движущей силой протекания химической реакции. Связь, образованную посредством перекрывания электронных облаков, то есть осуществляемую общей парой электронов с противоположными спинами, называют ковалентной связью. Если электронные облака перекрываются вдоль линии, соединяющей ядра атомов, образуется σ-связь. Если электронные облака перекрываются выше и ниже линии, соединяющей ядра атомов, образуется π-связь. σ-Связь более прочная, вокруг нее возможно вращение без ее разрыва. π-Связь менее прочная и образуется как дополнительная. Порядок (кратность) связи определяется числом общих электронных пар, осуществляющих связь между ядрами атомов. Основные характеристики ковалентной химической связи – длина связи, энергия связи. С увеличением кратности связи уменьшается длина связи и увеличивается суммарная энергия связи. Ковалентной связи присущи следующие особенности – насыщаемость и направленность. Насыщаемостьопределяет стехиометрию молекулярных химических соединений (формульный состав, массовые соотношения элементов) и валентные возможности атомов (способность образовать ограниченное число ковалентных связей). Общая пара связывающих электронов может образоваться в результате объединения взаимодействующими атомами неспаренных электронов с противоположными спинами (обменный механизм). Во многих случаях число связей, образованных атомом, оказывается больше числа неспаренных электронов в основном состоянии. Это объясняется возможностью образования связей из возбужденного состояния: происходит распаривание одной или нескольких внешних электронных пар с последующим переходом одного электрона от каждой пары на свободную орбиталь более высокого подуровня того же внешнего уровня. Энергия, затраченная на возбуждение атома, с большим избытком компенсируется энергией, выделяемой при образовании связей возбужденным атомом. Например, для бора характерно образование трех связей в соединениях (BF3) в результате перехода в возбужденное состояние с тремя неспаренными электронами: B …2s22p1 → B*…2s12p2.
Как правило, максимальная валентность элемента совпадает с номером группы, в которой он находится, исключение составляют N, O, F и некоторые d - металлы с почти заполненным предвнешним d - подуровнем.
Второй механизм образования ковалентной связи – донорно-акцепторный: один атом (донор) представляет неподеленную пару электронов, а другой (акцептор) свою вакантную орбиталь.
Контрольные вопросы:
1. Ионная связь. Металлическая связь.
1. Ковалентная химическая связь, длина, энергия связи, σ - и 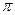 – связи.
– связи.
2. Насыщаемость ковалентной связи, валентности атомов.
Список рекомендуемой литературы:
1. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. - М.: КНОРУС, 2009. - С. 117 – 136, 145 - 154.
2. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов - 7-е изд., испр. - М.: Высшая школа, 2006. - С. 34 – 65.
Н.М. Шаймарданов
Дата добавления: 2015-08-08; просмотров: 1030;
