Лекция 1. Квантово-механическая модель строения атома
Ключевые слова: атом, корпускулярно-волновые свойства атомов, принцип неопределенности, квантовые числа, орбиталь, уровни и подуровни орбиталей.
Атом - химически неделимая единица вещества и представляет собой сложную электронейтральную микросистему находящихся в движении элементарных частиц. Характеристики основных элементарных частиц атома:
| Частица | протон | нейтрон | электрон |
| Масса, а.е.м. | 1,00728 | 1,00866 | 5,4858 10-4 |
| Заряд, отн. ед. | + 1 | - 1 |
В 1911 г. Э.Резерфорд предложил модель атома, согласно которой атом состоит из положительно заряженного ядра, в котором находится почти вся масса атома, и располагающихся вокруг ядра электронов. Ядро состоит из протонов и нейтронов. Число электронов равно числу протонов, и поэтому атом электронейтрален. Химический элемент - определенный вид атомов с одинаковым зарядом ядра. Атомы – наименьшие частицы химических элементов, являющихся носителями их химических свойств. Заряд ядра(сумма протонов) численно равен порядковому номеру элемента в периодической системе.В основе квантово-механической теории строения атомов лежит представление о двойственности природы электронов и других микрочастиц, то есть их корпускулярно-волновые свойства. С движущимся электроном ассоциируется волна, длина которой определяется уравнением Де-Бройля: 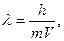 где λ - длина волны, (м); m - масса электрона; V-скорость движения частицы (≈108 м/с), h - постоянная Планка. Вторым фундаментальным принципом квантовой механики является принцип неопределенности Гейзенберга: невозможно описать с высокой степенью точности местонахождение электрона (координаты), и его энергию (импульс) в один и тот же момент времени. В квантовой механике электрон представляют как «облако отрицательного заряда», имеющее определенные размеры и форму. Уравнение Шрёдингера (1926 г.) описывает волновые и корпускулярные свойства электрона в атоме водорода. Решениями уравнения Шредингера являются энергии электрона и волновая функция ψ(пси). Решения его возможны только при определенных дискретных значениях энергии электрона: Е1, Е2, … Еn. Волновая функция ψ зависит от координат (x, y, z), и энергии E электрона и не имеет определенного физического толкования. Квадрат волновой функции ψ2 определяет плотность вероятности нахождения электрона в точке с координатами (x, y, z). ψ2·ΔV –вероятность нахождения электрона в данном объеме атома ΔV. Чем больше ψ2·ΔV, тем плотнее электронное облако в данном объеме атома. Каждой волновой функции соответствует набор из трех целочисленных параметров - квантовых чисел – n, l, ml. Область пространства, в которой вероятность нахождения электрона составляет не менее 90%, называют атомной орбиталью. Атомные орбитали различаются по энергии, размерам, форме, ориентации в пространстве и могут быть охарактеризованы тремя квантовыми числами (n, l, ml).
где λ - длина волны, (м); m - масса электрона; V-скорость движения частицы (≈108 м/с), h - постоянная Планка. Вторым фундаментальным принципом квантовой механики является принцип неопределенности Гейзенберга: невозможно описать с высокой степенью точности местонахождение электрона (координаты), и его энергию (импульс) в один и тот же момент времени. В квантовой механике электрон представляют как «облако отрицательного заряда», имеющее определенные размеры и форму. Уравнение Шрёдингера (1926 г.) описывает волновые и корпускулярные свойства электрона в атоме водорода. Решениями уравнения Шредингера являются энергии электрона и волновая функция ψ(пси). Решения его возможны только при определенных дискретных значениях энергии электрона: Е1, Е2, … Еn. Волновая функция ψ зависит от координат (x, y, z), и энергии E электрона и не имеет определенного физического толкования. Квадрат волновой функции ψ2 определяет плотность вероятности нахождения электрона в точке с координатами (x, y, z). ψ2·ΔV –вероятность нахождения электрона в данном объеме атома ΔV. Чем больше ψ2·ΔV, тем плотнее электронное облако в данном объеме атома. Каждой волновой функции соответствует набор из трех целочисленных параметров - квантовых чисел – n, l, ml. Область пространства, в которой вероятность нахождения электрона составляет не менее 90%, называют атомной орбиталью. Атомные орбитали различаются по энергии, размерам, форме, ориентации в пространстве и могут быть охарактеризованы тремя квантовыми числами (n, l, ml).
Главное квантовое число – n - принимает только целые положительные значения n = 1, 2, 3…∞. С увеличением n энергия и размер электронного облака (атомной орбитали) возрастает. Совокупность атомных орбиталей с одинаковым значением n называют уровнем, или электронным слоем. Максимально возможные числа орбиталей и электронов на уровне соответственно равны n2 и 2n2.
Орбитальное квантовое число l определяет значения орбитального момента количества движения электрона и принимает значения от 0 до (n-1), например, при n = 3: l = 0, 1, 2. Характеризует форму атомных орбиталей (электронных облаков), для которых в зависимости от l приняты соответствующие обозначения: l 0, 1, 2, 3, 4, 5…
обозначение s, p, d, f, g, h…
s - Орбиталь (s – электронное облако) имеет шарообразную форму. При l=1 зона вероятностного распределения электронов представляет собой гантелеобразное облако с центром в ядре (р-орбиталь). У d - орбитали (l = 2) и f - орбитали (l= 3) форма электронных облаков еще более сложная. Совокупность атомных орбиталей с одинаковым значением n и l называют подуровнем или электронной подоболочкой. Число возможных орбиталей и электронов в пределах подуровня соответственно равны (2l+1) и 2(2l+1).
Магнитное квантовое число ml может принимать положительные и отрицательные целочисленные значения от минус l до плюс l через нуль. В зависимости от значений ml определяются возможные ориентации орбиталей одной формы и их число, которое равно количеству значений ml. Так, для s - орбиталей (l = 0, ml = 0), возможна одна ориентация, поскольку шар симметричен относительно трех осей ординат. Для р - орбиталей (l=1, ml = -1, 0, +1), что соответствует трем ориентациям р - орбиталей относительно трех осей. Для d - орбиталей (l=2, ml = -2, -1, 0, +1, +2) число возможных ориентаций – пять, для f – орбиталей - семь.
Спиновое (ms) квантовое число характеризует сложное движение электрона вокруг собственной оси и принимает значения +1/2 или –1/2.
Контрольные вопросы:
1. Как вы понимаете корпускулярно-волновые свойства атомов?
2. Что такое орбиталь? Физический смысл Ψ2? Типы орбиталей?
3. Квантовые числа, что они описывают?
4. Что такое энергетический (электронный) уровень, подуровень?
Список рекомендуемой литературы:
1. Глинка Н.Л. Общая химия: учеб. пособие для вузов / Н.Л. Глинка. - М.: КНОРУС, 2009. - С. 60 - 88.
2. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов - 7-е изд., испр. - М.: Высшая школа, 2006. - С. 17 – 25.
Н.М. Шаймарданов
Дата добавления: 2015-08-08; просмотров: 1276;
