Кислоты
Кислотой называется соединение, образующее при диссоциации в водном растворе из положительных ионов только ионы водорода Н+(по теории электролитической диссоциации Аррениуса). Согласно протонной теории кислот и оснований, предложенной И. Бренстедом, кислотой называют вещество, отщепляющее при данной реакции протоны, а основанием – вещество, способное принимать протоны.
Любая реакция отщепления протона выражается уравнением: кислота → основание + Н+
Г. Льюис предположил, что кислотно-основные взаимодействия совсем необязательно происходят с переносом протона. В определении кислот и оснований по Льюису основная роль отводится участию электронных пар в химическом взаимодействии.
Катионы, анионы или нейтральные молекулы, способные принять одну или несколько пар электронов, называют кислотами Льюиса.
Так, например, фторид алюминия AlF3 – кислота, способная принимать электронную пару при взаимодействии с аммиаком:
AlF3 + :NH3 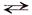 [AlF3]:[NH3]
[AlF3]:[NH3]
Катионы, анионы или нейтральные молекулы, способные отдавать электронные пары, называют основаниями Льюиса. В приведенном примере аммиак является основанием.
Поскольку существуют различные определения кислот, то их классификация и номенклатура довольно условны.
По числу атомов водорода, способных к отщеплению в водном растворе, кислоты делят на одноосновные (например, HCl, HNO3), двухосновные (Н2СО3, Н2SO4) и трехосновные (Н3РO4).
По составу кислоты делят на бескислородные (НBr, Н2S) и кислородсодержащие (НСlO4, Н2CO3).
Названия бескислородных кислот производятся от названия неметалла с прибавлением окончания -водородная:
| Формула и название бескислородных кислот | Название соответствующих нормальных солей |
| НF – фтороводородная кислота | Фториды |
| НСl – хлороводородная (соляная) кислота | Хлориды |
| НВr – бромоводородная кислота | Бромиды |
| НI – иодоводородная кислота | Иодиды |
| Н2S – сероводородная кислота | Сульфиды |
| Н2Sе – селеноводородная кислота | Селениды |
Обычно названия кислородных кислот производятся от названия неметалла с прибавлением окончаний -ноя, -воя, если степень окисления неметалла равна номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая:
| Формула и название кислородных кислот | Название соответствующих нормальных солей |
| НСlO4 – хлорная кислота | Перхлораты |
| НСlO3 – хлорноватая кислота | Хлораты |
| НСlO2 – хлористая кислота | Хлориты |
| НСlO – хлорноватистая кислота | Гипохлориты |
| Н2СО3 – угольная кислота | Карбонаты |
| Н3AsO4 – мышьяковая кислота | Арсенаты |
| НNO3 – азотная кислота | Нитраты |
| НNO2 – азотистая кислота | Нитриты |
| Н2SO4 – серная кислота | Сульфаты |
| Н2SO3 – сернистая кислота | Сульфиты |
| H3PO4 – фосфорная кислота | Фосфаты (ортофосфаты) |
| H2SiO3 – кремниеваая | Силикаты |
| H3BO3 – борная | Бораты (ортобораты) |
В ряду НСlO – НСlO2 НСlO3 НСlO4 происходит усиление кислотных свойств с возрастанием степени окисления центрального атома, т.к. уменьшается прочность связи О–Н (когда образуется новая связь кислорода с хлором, от атома хлора, а следовательно, и от первичной связи O–Сl оттягивается некоторая доля электронной плотности, в результате этого часть электронной плотности оттягивается и от связи О–Н, которая за счет этого ослабляется). Такая закономерность характерна для других элементов.
Получение кислот.
1. Бескислородные кислоты могут быть получены при непосредственном соединении неметаллов с водородом:
Н2 + Cl2 → 2НСl
Н2 + S 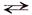 Н2S
Н2S
2. Кислородсодержащие кислоты нередко могут быть получены при взаимодействии кислотных оксидов с водой.
SO3 + H2O → H2SO4
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами:
BaBr2 + H2SO4 → BaSO4↓ + 2HBr
CuSO4 + H2S → H2SO4 + CuS↓
AgNO3 + HCl → AgCl↓ + HNO3
4. В ряде случаев для получения кислот могут быть использованы окислительно-восстановительные реакции:
3Р + 5HNO3 + 2Н2О = 3Н3РO4 + 5NO↑
Химические свойства кислот можно разделить на две группы:
1) общие для всех кислот реакции, связанные с наличием в их растворах иона Н* (иона гидроксония Н3О+);
2) специфические т.е. характерные для конкретных кислот.
К первому типу превращений кислот относятся реакции кислот с металлами, стоящими в ряду напряжений до водорода, например
Zn + 2HCl → ZnCl2 + H2
CuO + H2SO4 → CuSO4 + H2O
NaOH + HNO3 → NaNO3 + H2O
Частным случаем кислотно-основного взаимодействия являются реакции кислот с индикаторами, приводящие к изменению окраски. Причины изменения окраски индикаторов связаны с изменением строения и вытекающим отсюда изменением светопоглощения.
| Индикатор | Кислая среда рН < 7 | Нейтральная среда pH = 7 | Щелочная среда pH > 7 |
| лакмус | красный | фиолетовый | синий |
| метилоранж | красный | оранжевый | желтый |
| конго красный | синий | красный | красный |
| фенолфталеин | бесцветный | бесцветный | красный |
Вторая группа реакций кислот связана со специфическими особенностями различных кислот и подразделяется на два типа: реакции, приводящие к образованию нерастворимых солей, и окислительно-восстановительные превращения (качественные реакции).
Аg+ + Сl → AgCl↓ белый осадок
Ва2+ + SO42– → ВаSO4↓ белый осадок
3Аg++РO43– →Аg3РO4↓ желтый осадок
Другой большой подкласс специфических реакций кислот связан с их окислительно-восстановительными возможностями.
Бескислородные кислоты в водном растворе могут только окисляться:
2КМnO4 + 16НСl = 5Сl2 + 2КСl + 2МnСl2 + 8Н2О
Многие кислородсодержащие кислоты, в которых центральный атом имеет максимальную степень окисления проявляют свойства сильных окислителей:
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
C + 2H2SO4(конц.) → CO2 + SO2 + 2H2O
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2 + 2H2O
Соли
Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда, кроме них, ионы водорода Н+ и гидроксид-ионы ОН–.
Соли принято делить на три группы: средние, кислые и основные:
- в средних солях все атомы водорода соответствующей кислоты замещены на атомы металла: хлорид натрия NaCl, сульфид железа (II) FeS, карбонат кальция СаСО3, сульфат железа (III) Fe2(SO)3, перманганат калия КМnO4, дихромат калия К2Cr2O7.
По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначается приставкой гидро-, а группа ОН – приставкой гидрокси-.
- в кислых солях атомы водорода соответствующей кислоты замещены только частично: NaHS – гидросульфид натрия, NaHSO3 – гидросульфит натрия.
- в основных солях группы ОН– соответствующего основания частично замещены на кислотные остатки: Мg(ОН)Сl – гидроксихлорид магния, Аl(ОН)2Сl – дигидроксихлорид алюминия.
Существуют также некоторые другие типы солей, например: двойные соли – СаСО3∙МgСО3 (доломит), КСl∙МаСl (сильвинит), КАl(SO4)2 (алюмокалиевые квасцы); смешанные соли – СаОСl2 или Са(ОСl)Сl; комплексные соли, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами – K3[Fe(СN)6] (красная кровяная соль или гексацианоферрат (III) калия), [Ag(NH3)2]Сl хлорид диамминсеребра (I); гидратные соли, в которых содержатся молекулы кристаллизационной воды – CuSO4∙5H2O (пентагидрат сульфата меди (II) или медный купорос), Na2SO4∙10Н2O глауберова соль.
Способы получения. Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Соли бескислородных кислот, кроме того, могут быть получены при непосредственном взаимодействии металлов и неметаллов.
Химические свойства.Многие соли устойчивы при нагревании. Однако, соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются:
NH4Cl → NH3 + HCl NH4NO3 → N2O + 2H2O
CaCO3 → CaO + CO2 2KNO3 → 2KNO2 + O2
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O 2KClO3 → 2KCl + 3O2
Соли могут реагировать с кислотами, солями или основаниями, а также проявлять окислительные и восстановительные свойства.
AgNO3 + KBr → AgBr + KNO3
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Zn + CuSO4 → ZnSO4 + Cu
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Растворимость важнейших солей в воде:
- все соли HNO3 и СН3СООН растворимы;
- большинство солей HCl растворимы (кроме AgCl, CuCl, PbCl2, Hg2Cl2);
- большинство солей H2SO4 растворимы (кроме BaSO4, SrSO4, PbSO4; CaSO4 малораствор-м);
- средние соли слабых и средних кислот (H3PO4, H2SiO3, HNO2, H2S, H2CO3 и др.) не растворимы, кроме солей NH4+ и щелочных металлов (без Li);
- большинство кислых солей растворимы (кроме CaHPO4; Ca(H2PO4)2 малорастворим).
Дата добавления: 2015-08-08; просмотров: 2705;
