Глава 11. ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
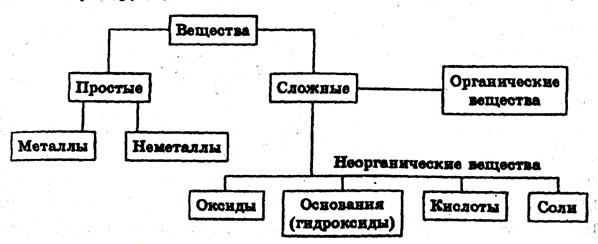
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ (около 400) и очень многочисленную группу сложных веществ.
Приведенная первичная классификация несовершенна. Так, в ней нет места для аммиака, соединений металлов с водородом, азотом, углеродом, фосфором и т.д., соединений неметаллов с другими неметаллами и т.д.
Все вещества делятся на простые и сложные. Простое вещество представляет собой гомоатомное химическое соединение. Сложные вещества состоят из двух или более элементов и по составу разделяются на бинарные (двухатомные) и многоэлементные соединения.
Все простые вещества подразделяются на металлы и неметаллы. Эта классификация основана на существенно различном характере физических и химических свойств веществ. Причины различий между металлами и неметаллами кроется в разном типе межатомного взаимодействия при образовании простых веществ. Преобладание вклада металлической связи приводит к металлическим свойствам простого вещества, а неметаллические свойства обусловлены преимущественно ковалентными взаимодействиями. Для образования ковалентной связи, свободно взаимодействующие атомы должны обладать достаточным числом валентных электронов. При дефиците валентных электронов осуществляется коллективное электронно-атомное взаимодействие, приводящее к возникновению металлических свойств.
Металлы и неметаллы различаются по физическим свойствам, которые проявляются у соответствующих простых веществ. Так, для металлов характерны высокая тепло- и электрическая проводимость, специфический металлический блеск, ковкость, пластичность и т. п. Физические свойства неметаллов существенно отличаются: они хрупкие, обладают низкой тепло- и электрической проводимостью и т. п. Различия между металлами и неметаллами проявляются в их химических свойствах: для металлов характерны оснóвные свойства оксидов и гидроксидов, восстановительное действие; для неметаллов – кислотный характер оксидов и гидроксидов, окислительная активность. Но деление химических элементов на металлы и неметаллы относительно, т. к. существуют амфотерные элементы.
К важнейшим бинарным соединениям относятся соединения элементов с кислородом (оксиды), галогенами (галогениды или галиды), азотом (нитриды), углеродом (карбиды), а также соединения металлов с водородом (гидриды), кремнием (силициды), бором (бориды). Названия бинарных соединений образуются из латинского корня более электроотрицательного элемента с окончанием -ид и русского названия менее отрицательного элемента в родительном падеже.
Многоэлементные соединения традиционно подразделяют на три класса: основания, кислоты и соли. В эту же классификацию обычно включают и комплексные соединения.
Ниже рассмотрим важнейшие классы неорганических соединений – оксиды, гидроксиды и соли.
Оксиды
Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород. Согласно современной международной номенклатуре любой оксид называется оксидом с указанием римскими цифрами степени окисления элемента, например: SO2 – оксид серы (IV), SO3 – оксид серы (VI), CrO – оксид хрома (II), Cr2O3 – оксид хрома (III), CrO3 – оксид хрома (VI).
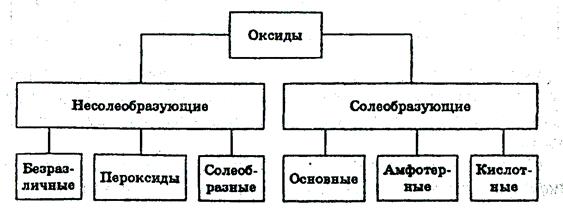
Наиболее важные несолеобразующие оксиды – СО, NO, H2O2, Na2O2.
Оснóвные оксиды– оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение оснóвных оксидов.
2Mg + O2 → 2MgO
Cu(OH)2 → CuO + H2O
BaCO3 → BaO + СO2
2Pb(NO3)2 → 2PbO + 4NO2 + O2
Химические свойства основных оксидов.
Большинство оснóвных оксидов представляет собой твердые кристаллические вещества ионного характера, они обладают высокими температурами плавления и кипения.
Оснóвные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами:
BaO + SiO2 → Ba2SiO3
MgO + Al2O3 → Mg(AlO2)2
ZnO + H2SO4 → ZnSO4 + H2O
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
K2O + H2O→ 2KOH
СаО + Н2О → Са(ОН)2
Кислотные оксиды – оксиды неметаллов или переходных металлов в высоких степенях окисления
Получение кислотных оксидов.
4Р+5O2 → 2Р2O5
2ZnO + 3O2 → 2ZnO + 2SO2
Na2SiO3 + 2HCl → 2NaCl + SiO2↓ + H2O
Химические свойства кислотных оксидов.
Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:
SO3 + H2O → H2SO4 CO2 + H2O → H2CO3
P2O5 + 3H2O → 2H3PO4
Наиболее типичными для кислотных оксидов являются их реакции с оснóвными и амфотерными оксидами, с щелочами:
P2O5 + Al2O3 → 2AlPO4
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Амфотерные оксидыобладают двойственной природой: они одновременно способны к реакциям, в которые вступают как оснóвные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
К числу амфотерных оксидов относятся оксид алюминия Al2O3, оксид хрома (III) Cr2O3, оксид бериллия ВеО, оксид цинка ZnO, оксид железа (III) Fe2O3 и ряд других. Идеально амфотерным оксидом является вода H2O.
Основания (гидроксиды металлов)
Основанием называется соединение, образующее при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы ОН–.
Гидроксиды металлов принято делить на две группы: растворимые в воде – щелочи [образованные щелочными LiOH, NaOH, KOH, RbOH, CsOHи щелочноземельными металлами Ca(OH)2, Sr(OH)2, Ba(OH)2] и нерастворимые в воде (все остальные гидроксиды металлов).
Получение оснований. Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как нерастворимые, так и растворимые основания:
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
Щелочи в технике обычно получают электролизом водных растворов хлоридов:
2NaCl + 2Н2O → 2NаОН + Н2 + Сl2
Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой:
2Na + H2O → 2NaOH + H2↑ 2LiO + H2O → 2LiOH
Гидроксиды серебра, ртути настолько легко распадаются, что при попытке их получения обменной реакцией вместо гидроксидов выпадают оксиды:
2AgNО3 + 2КОН = Ag2O↓ + Н2О + 2KNO3
Химические свойства оснований. Все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов:
2Fe(OH)3 → Fe2O3 + H2O Ca(OH)2 → CaO + H2O
Наиболее характерной реакцией оснований является их взаимодействие с кислотами – реакция нейтрализации. В нее вступают как щелочи, так и нерастворимые основания:
NаОН + НNО3 → NаNО3 + Н2O
Cu(ОН)2 + Н2SO4 → СuSO4 + 2H2O
Растворы щелочей способны реагировать с некоторыми неметаллами (галогенами, серой, белым фосфором, кремнием):
2NаОН + Сl2 → NaCl + NaClO + Н2O (на холоде)
6КОН + 3Сl2 → 5КСl + КClO3 + 3Н2О (при нагревании),
6КОН + 3S → К2SO3 + 2К2S + 3Н2О
Нерастворимые основания не реагируют с металлами.
Концентрированные растворы щелочей при нагревании взаимодействуют с некоторыми металлами (соединения которых обладают амфотерными свойствами):
2Аl + 2NаОН + 6Н2О = 2Nа[Аl(ОН)4] + 3Н2↑
Zn + 2КОН + 2Н2О = К2[Zn(ОН)4] + Н2↑
Амфолиты– это гидроксиды, которые проявляют как основные, так и кислотные свойства – Сr(ОН)3, Zn(OH)2, Be(OH)2, Аl(OН)3 и др. Амфотерные гидроксиды способны реагировать как с кислотами, так и со щелочами. С кислотами они реагируют как основания, а со щелочами – как кислоты.
Дата добавления: 2015-08-08; просмотров: 1829;
