Миофибриллы
Поперечная исчерченность скелетного мышечного волокна определяется регулярным чередованием в миофибриллах различно преломляющих поляризованный свет участков (дисков) — изотропных и анизотропных: светлые (Isotropic, I-диски) и тёмные (Anisotropic, А-диски) диски. Разное светопреломление дисков определяется упорядоченным расположением по длине саркомера тонких и толстых нитей; толстые нити находятся только в тёмных дисках, светлые диски не содержат толстых нитей. Каждый светлый диск пересекает Z-линия. Участок миофибриллы между соседними Z-линиями определяют как саркомер.
Саркомер.Структурно-функциональная единица миофибриллы, находящаяся между соседними Z-линиями (рис. 7-3). Саркомер образуют расположенные параллельно друг другу тонкие (актиновые) и толстые (миозиновые) нити. I-диск содержит только тонкие нити. В середине I-диска проходит Z-линия. Один конец тонкой нити прикреплён к Z-линии, а другой конец направлен к середине сaркомера. Толстые нити занимают центральную часть сaркомера — А-диск. Тонкие нити частично входят между толстыми. Содержащий только толстые нити участок сaркомера — Н-зона. В середине Н-зоны проходит М-линия. I-диск входит в состав двух сaркомеров. Следовательно, каждый сaркомер содержит один А-диск (тёмный) и две половины I-диска (светлого), формула саркомера — ½ I + А + ½ I.
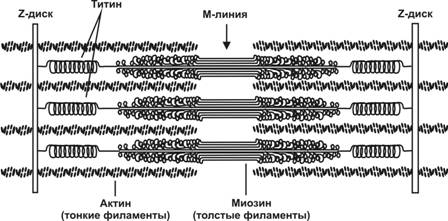
Рис.7-3.Саркомерсодержит один А-диск (тёмный) и две половины I-диска (светлого). Толстые миозиновые нити занимают центральную часть саркомера. Титин соединяет свободные концы миозиновых нитей с Z-линией. Тонкие актиновые нити одним концом прикреплены к Z-линии, а другим направляются к середине сaркомера и частично входят между толстыми нитями. [17]
Толстая нить. Каждая миозиновая нить состоит из 300–400 молекул миозина и С–белка. Половина молекул миозина обращена головками к одному концу нити, а вторая половина — к другому. Гигантский белок титин связывает свободные концы толстых нитей с Z-линией.
Миозин (рис. 7-4). В молекуле миозина различают тяжёлый и лёгкий меромиозины. Тяжёлый меромиозин имеет два субфрагмента (S). S1 содержит глобулярные головки миозина, S2 — эластический компонент, допускающий отхождение S1 на расстояние до 55 нм. Концевую часть хвостовой нити миозина длиной 100 нм образует лёгкий меромиозин. Миозин имеет два шарнирных участка, позволяющих молекуле изменять конформацию. Один шарнирный участок находится в области соединения тяжёлого и лёгкого меромиозинов, другой — в области шейки молекулы миозина (соединение S1S2). Лёгкий меромиозин лежит в толще толстой нити, тогда как тяжёлый меромиозин (благодаря шарнирным участкам) выступает на её поверхность (рис. 7-5).
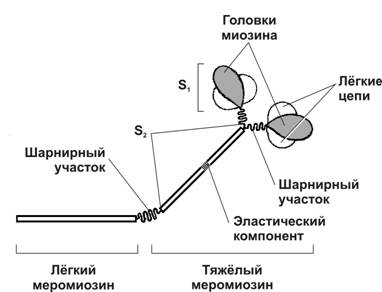
Рис. 7-4. Молекула миозина.Лёгкий меромиозин обеспечивает агрегацию молекул миозина, тяжёлый меромиозин имеет связывающие актин участки и обладает активностью АТФазы. [17]
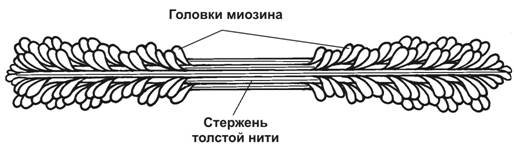
Рис.7-5.Толстая нить. Молекулы миозина способны к самосборке и формируют веретенообразный агрегат диаметром 15нм и длиной 1,5мкм. Фибриллярные хвосты молекул образуют стержень толстой нити, головки миозина расположены спиралями и выступают над поверхностью толстой нити. [17]
Титин — наибольших размеров полипептид (из известных) с Mr 3000 кД — работает наподобие молекулярной пружины, обеспечивая структурную целостность миофибрилл во время сокращения. Один конец молекулы проникает в Z-линию и через актинин связывается с молекулой титина соседнего саркомера, другой конец приближается к М-линии и при помощи миомезина (М-белок) прикрепляется к свободному концу молекулы титина второй половины саркомера. В I-диске титин ассоциирован с тонкими нитями, а в А-диске этот белок связывается с толстыми нитями. Контактируя в области Z-линии и М-линии, молекулы титина образуют непрерывную цепь.
С-белок стабилизирует структуру миозиновых нитей. Влияя на агрегацию молекул миозина, обеспечивает одинаковый диаметр и стандартную длину толстых нитей.
Креатинфосфокиназа ассоциирована с толстыми нитями в середине тёмного диска, способствует быстрой регенерации АТФ из АДФ при сокращении.
Тонкая нить состоит из актина, тропомиозина и тропонинов (рис. 7-6).
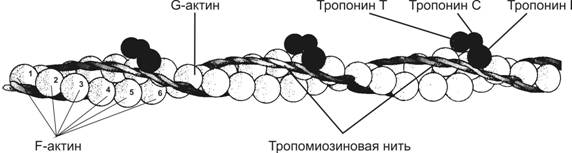
Рис.7-6. Тонкая нить — две спирально скрученные нити F–актина. В канавках спиральной цепочки залегает двойная спираль тропомиозина, вдоль которой располагаются молекулы тропонина. [17]
Актин. Молекулы глобулярного актина (G–актин) полимеризуются и образуют фибриллярный актин (F–актин). В состав тонкой нити входят две спирально закрученные цепочки F–актина.
Тропомиозин состоит из двух полипептидных цепей и имеет конфигурацию двойной спирали. Полярные молекулы тропомиозина длиной 40 нм укладываются конец в конец в желобке между двумя спирально закрученными цепочками F–актина. Существует как минимум четыре гена, кодирующих мышечные и немышечные изоформы тропомиозина.
Немалиновая миопатия — мутация гена тропомиозина-3, передающаяся по аутосомно-доминантному типу. При биопсии в саркоплазме мышечных волокон I типа обнаруживаются палочковидные включения, формирующиеся из материала Z-линий.
Тропонин (Tn) — комплекс, образованный тремя глобулярными СЕ: TnT, TnI, TnC. ТnT имеет участки для связи с тропомиозином. TnC — Ca2+-связывающий белок. TnIпрепятствует взаимодействию актина с миозином. Тропониновый комплекс прикреплён к молекулам тропомиозина с интервалами 40 нм.
Небулин — фибриллярный белок, ассоциированный с тонкими нитями. Небулин проходит от Z-линии до свободного конца тонких нитей и контролирует их длину.
–Актинин, десмин и виментин — входят в состав Z-линии, в которую вплетён один конец тонкой нити.
Дата добавления: 2015-07-07; просмотров: 4612;
