СХЕМА ФАЗОВЫХ ПРЕВРАЩЕНИЙ ОДНОКОМПОНЕНТНЫХ СИСТЕМ
Углеводородные газы, подобно всем индивидуальным веществам, изменяют свой объём при изменении температуры. На рис. 4.1. представлена диаграмма фазового состояния для чистого этана. Каждая из кривых соответствует фазовым изменениям при постоянной температуре и имеет три участка. Слева от пунктирной линии отрезок соответствует газовой фазе, горизонтальный участок – двухфазной газожидкостной области, левый участок – жидкой фазе. Отрезок пунктирной линии вправо от максимума в точке C называется кривой точек конденсации (или точек росы), а влево от максимума – кривой точек парообразования (кипения). В точке C пунктирной линии кривые парообразования и конденсации сливаются. Эта точка называется критической.
С приближением температуры и давления к критическим значениям свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает, и плотности их уравниваются. Следовательно, с приближением к критической точке по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конденсации, то плотность пара будет непрерывно возрастать.
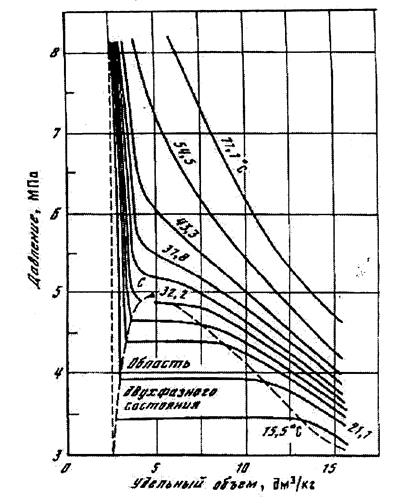
Рис.4.1. Диаграмма фазового состояния чистого этана
Для индивидуальных углеводородов граничным давлением между жидкой и газовой фазой является давление упругости паров (при данной температуре), при котором происходит конденсация или испарение. Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара над жидкостью.
Фазовые превращения углеводородов можно также представить в координатах давление-температура (рис.4.2). Для однокомпонентной системы кривая давления насыщенного пара на графике давление-температура является одновременно кривой точек начала кипения и линией точек росы. При всех других давлениях и температурах вещество находится в однофазном состоянии.
Фазовая диаграмма индивидуальных углеводородов ограничивается критической точкой C (рис. 4.2). Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых ещё могут существовать две фазы одновременно.
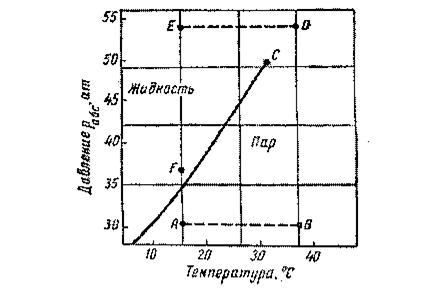
Рис. 4.2. Диаграмма фазового состояния чистого этана в координатах Т-Р
Из рисунка 4.2 следует, что путём соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Газ, характеризующийся параметрами точки A (рис. 4.2), можно изобарически нагреть до температуры точки B, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область точки D, расположенную выше критической точки C, и далее в область точки E. Свойства системы при этом изменяются непрерывно, и разделения углеводорода на фазы не произойдёт. При дальнейшем охлаждении системы (от точки D до точки E), а затем при снижении давления до точки F вещество приобретает свойства жидкости, минуя область двухфазного состояния.
Значительно сложнее закономерности фазовых переходов двух- и многокомпонентных систем.
В смеси углеводородов каждый компонент имеет собственные значения упругости насыщенных паров, поэтому процессы конденсации и испарения не будут проходить при конкретных значениях давления и температуры, а в определённом диапазоне значений давления и температуры. Границы диапазона будут тем больше, чем больше разница между критическими значениями давления и температуры индивидуальных компонентов, входящих в систему. Более подробную информацию по фазовым переходам многокомпонентных систем можно найти в литературе [3,4].
Дата добавления: 2015-08-08; просмотров: 1111;
